
| A. | CuO | B. | MnO2 | C. | Fe2O3 | D. | Fe3O4 |
分析 管内物质减少的质量即为化合物失去氧的质量,可设化学式中氧原子的个数均为一个,即“RXO”,则四种氧化物的化学式经“缩小”后变换为:CuO,Mn1/2O,Fe2/3O,Fe3/4O,据题意得$\frac{16}{16+xM}$=27.5%(M为R的相?原子质量),所以x•M=42,据此进行分析.
解答 解:管内物质减少的质量即为化合物失去氧的质量,可设化学式中氧原子的个数均为一个,即“RXO”,则四种氧化物的化学式经“缩小”后变换为:CuO,Mn1/2O,Fe2/3O,Fe3/4O,据题意得$\frac{16}{16+xM}$=27.5%(M为R的相?原子质量),所以x•M=42,
A.CuO,则x•M=64,故A错误;
B.Mn1/2O,则x•M=55×$\frac{1}{2}$=22.5,故B错误;
C.Fe2/3O,则x•M=56×$\frac{2}{3}$=37.3,故C错误;
D.Fe3/4O,则x•M=56×$\frac{3}{4}$=42,故D正确.
故选D.
点评 明确管内物质减少的质量即为化合物失去氧的质量,是本题解题的关键,本题题目难度中等.


科目:高中化学 来源: 题型:解答题
| 时间(mim) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(ML) | 50 | 120 | 232 | 290 | 310 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl反应 | |
| B. | 铝与稀盐酸 | |
| C. | 灼热的炭与水蒸气生成一氧化碳和氢气的反应 | |
| D. | 煤与O2的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
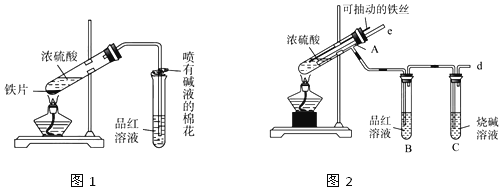
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 放电时钠金属片发生氧化反应 | |
| B. | 充电时碳纳米管接直流电源的正极 | |
| C. | 放电时每消耗3molCO2,转移12 mol电子 | |
| D. | 充电时的阳极反应为C+2Na2CO3-4e-=3CO2↑+4Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
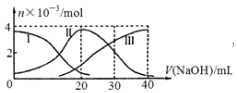 手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )
手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,如图是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA-,Ⅲ代表A2-,下列说法正确的是( )| A. | H2A在水中的电离方程式是:H2A═2H++A2- | |
| B. | 当V(NaOH)=40mL时,其溶液中水的电离受到抑制 | |
| C. | 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) | |
| D. | 当V(NaOH)=30mL时,则有:c(H+)+c(Na+)═c(A2-)+c(OH-)+c(HA-) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com