

分析 根据实验装置图可知,在A中用高锰酸钾与浓盐酸制得氯气,氯气中有挥发的氯化氢在B装置中用饱和食盐水除去,氯得的氯气通入氢氧化钾溶液中搅拌,生成次氯酸钾,实验中氯气尾气在D装置中用氢氧化钾溶液吸收,
(1)KMnO4具有强氧化性,将盐酸中氯离子氧化为Cl2,反应还有水生成,KMnO4、HCl、MnCl2改写成离子形式,Cl2、H2O为分子式形式,配平书写离子方程式;
盐酸易挥发,制备的氯气中含有HCl,应饱和食盐水吸收HCl除去;
(2)Cl2和KOH在较高温度下反应生成KClO3,制取KClO温度反应在0℃~5℃,装置C应放在冰水浴中,充分利用原料,应降低通入氯气的速率;
(3)K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中;
(4)用砂芯漏斗过滤,除去氢氧化铁,由于K2FeO4可溶于水、微溶于浓KOH溶液,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,析出K2FeO4晶体,再进行过滤,用乙醇洗涤,减少因溶解导致晶体损失,最后在真空干燥箱中干燥.
解答 解:(1)KMnO4具有强氧化性,将盐酸中氯离子氧化为Cl2,反应还有水生成,KMnO4、HCl、MnCl2改写成离子形式,Cl2、H2O为分子式形式,离子方程式为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
由于盐酸易挥发,制备的氯气中含有HCl,而氯化氢在饱和食盐水中溶解度较小,应饱和食盐水吸收氯气中的HCl,
故答案为:2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;HCl;
(2)Cl2和KOH在较高温度下反应生成KClO3,制取KClO温度反应在0℃~5℃,装置C应放在冰水浴中,充分利用原料,缓慢滴加盐酸,减慢生成氯气的速率,
故答案为:缓慢滴加盐酸、装置C用冰水浴中;
(3)K2FeO4在Fe3+和Fe(OH)3催化作用下发生分解,应把Fe(NO3)3饱和溶液滴加到KClO溶液中,具体操作为:在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中,
故答案为:在搅拌下,将Fe(NO3)3饱和溶液缓慢滴加到KClO 饱和溶液中;
(4)提纯K2FeO4粗产品[含有Fe(OH)3、KCl等杂质]的实验方案为:将一定量的K2FeO4粗产品溶于冷的3mol•L-1KOH溶液中,用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2-3次后,在真空干燥箱中干燥,
故答案为:用砂芯漏斗过滤,将滤液置于冰水浴中,向滤液中加入饱和的KOH溶液,再用砂芯漏斗过滤,晶体用乙醇洗涤2-3次后,在真空干燥箱中干燥.
点评 本题考查实验制备方案的设计,题目难度中等,明确实验目的、实验原理为解答关键,(4)为难点,注意掌握化学实验方案设计原则,试题培养了学生的分析、理解能力及化学实验能力.


 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案 单元加期末复习先锋大考卷系列答案
单元加期末复习先锋大考卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 18OD-离子中,质子数、电子数、中子数之比为9:10:11 | |
| B. | H2O和CCl4分子中所有原子均满足最外层8电子结构 | |
| C. | 元素性质呈周期性变化的实质是元素化合价呈周期性变化 | |
| D. | 115号元素位于周期表第六周期第ⅤA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 等浓度的H2CO3、Na2CO3溶液中c(HCO3-)前者小 | |
| B. | 反应HCO3-+H2O?H2CO3+OH-的平衡常数为10-5.37 | |
| C. | 1L0.1mol•L-1NaHC2O4溶液和1L0.1mol•L-1的NaOH溶液混合,混合液中c(HC2O4-)+c(C2O42-)+c(H2C2O4)=0.1mol•L-1 | |
| D. | Na2CO3溶液中加入过量草酸溶液,发生反应:CO32-+H2C2O4═HCO3-+HC2O4- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HCl、CuCl2、Ba(OH)2 | B. | NaOH、CuSO4、H2SO4 | ||
| C. | Ba(OH)2、H2SO4、K2SO4 | D. | NaBr、H2SO4、Ba(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| X | Y | |
| Z | W |
 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:填空题

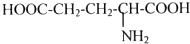 (填结构简式)可以合成下列二肽:
(填结构简式)可以合成下列二肽:

 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com