
X、Y、Z、M代表四种金属元素.金属X和Z用导线连接放入稀硫酸中时,X溶解,Z极上有氢气放出;若电解Y2+和Z2+离子共存的溶液时,Y先析出;又知M2+离子的氧化性强于Y2+离子.则这四种金属的活动性由强到弱的顺序为( )
A.X>Y>Z>M B. X>Z>Y>M C. M>Z>X>Y D. X>Z>M>Y
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年天津一中高一下期末化学试卷(解析版) 题型:选择题
某溶液中可能含有 Cl- 、SO42-、CO32-、NH4+、Fe3+、Al3+、K+ 。取该溶液100mL,加入过量 NaOH 溶液,加热,得到 0.02mol 气体,同时产生红褐色沉淀;过滤、洗涤灼烧,得 1.6g 固体,向上述溶液 中加足量 BaCl2 溶液,得到 4.66g 不溶于盐酸的沉淀,由此可知原溶液中
A.至少存在 5 种离子
B.Cl-一定存在,且 c(Cl-) ≥ 0.4mol·L-1
C.SO42-、NH4+一定存在,Cl- 可能不存在
D.CO32-、Al3+一定不存在,K+可能存在
查看答案和解析>>
科目:高中化学 来源:2015-2016学年天津静海一中等校高一下期末化学试卷(解析版) 题型:选择题
下列常见金属的冶炼原理中不合理的是
金属 | 冶炼原理 | |
A | Fe | Fe2O3+3CO |
B | Hg | 2HgO |
C | Al | 2Al2O3 |
D | Na | 2NaCl(熔融) |
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高二下期末化学试卷(解析版) 题型:填空题
研究氮的固定具有重要意义。
(1)雷雨天气中发生自然固氮后,氮元素转化为 而存在于土壤中.处于研究阶段的化学固氮新方法是N2在催化剂表面与水发生如下反应:
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H K ①
已知:N2(g)+3H2(g)=2NH3(g)△H1=﹣92.4kJ•mol﹣1 K1 ②
2H2(g)+O2(g)=2H2O(l)△H2=﹣571.6kJ•mol﹣1 K2 ③
则△H= ;K= (用K1和 K2表示)。
(2)在四个容积为2L的密闭容器中,分别充入1mol N2、3mol H2O,在催化剂条件下进行反应①3小时,实验数据见下表:
序号 | 第一组 | 第二组 | 第三组 | 第四组 | ||||||||||
t/℃ | 30 | 40 | 50 | 80 | ||||||||||
NH3生成量/(10﹣6mol) | 4.8 | 5.9 | 6.0 | 2.0 | ||||||||||
下列能说明反应①达到平衡状态的是 (填字母)。K]
a.NH3和O2的物质的量之比为4:3
b.反应混合物中各组份的质量分数不变
c.单位时间内每消耗1molN2的同时生成2molNH3
d.容器内气体密度不变
若第三组反应3h后已达平衡,第三组N2的转化率为 ;与前三组相比,第四组反应中NH3生成量最小的原因可能是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高二下期末化学试卷(解析版) 题型:选择题
加热N2O5依次发生的分解反应为:①N2O5(g) N2O3(g)+O2(g);②N2O3(g)
N2O3(g)+O2(g);②N2O3(g) N2O(g)+O2(g)在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为( )
N2O(g)+O2(g)在容积为2L的密闭容器中充入8mol N2O5,加热到t℃,达到平衡状态后O2为9mol,N2O3为3.4mol.则t℃时反应①的平衡常数为( )
A.10.7 B. 8.5 C. 9.6 D. 10.2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年辽宁庄河高中高二下期末化学试卷(解析版) 题型:选择题
下列离子方程式中,正确的是( )
A. Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH﹣+O2↑
B. 向稀硝酸中加入少量铁粉:3Fe+8H++2NO3﹣=3Fe2++2NO↑+4H2O
C. 氯化镁溶液与氨水反应:Mg2++2OH﹣=Mg(OH)2↓
D. 向明矾溶液中加入过量的氢氧化钡溶液:Al3++2SO42﹣+2Ba2++4OH﹣=2BaSO4↓+AlO2﹣+2H2O
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省松原市高一下期末化学试卷(解析版) 题型:填空题
(1)分析如图所示的三个装置,回答下列问题:

①装置a中铝电极上的电极反应式为________________________。
②装置b中产生气泡的电极为________电极(填“铁”或“铜”),装置c中铜电极上的电极反应式为_____________________________________。
燃料电池是一种高效低污染的新型电池。燃料电池所用燃料可以是氢气,也可以是其他燃料,如甲烷、肼等。
(2)如图是甲烷燃料电池原理示意图,回答下列问题:

①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为:__________________。
②电池工作一段时间后电解质溶液的pH________(填“增大”“减小”或“不变”)。
(3)肼分子(H2N—NH2)可以在氧气中燃烧生成氮气和水,利用肼、氧气与KOH溶液组成碱性燃料电池,请写 出该电池反应的负极电极反应式______________________________。
出该电池反应的负极电极反应式______________________________。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年吉林省松原市高一下期末化学试卷(解析版) 题型:选择题
已知同一条件下,通过以下反应均可获取H2,下列有关说法正确的是
①太阳光催化分解水制氢:2H2O(l) = 2H2(g)+ O2(g) ΔH1= + 571.6kJ·mol–1
②焦炭与水反应制氢:C(s)+ H2O(g) = CO(g)+ H2(g)ΔH2= + 131.3kJ·mol–1
③甲烷与水反应制氢:CH4(g)+ H2O(g) = CO(g)+3 H2(g)ΔH3= + 206.1kJ·mol–1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)= C(s)+2 H2(g)的ΔH = + 74.8kJ·mol–1
查看答案和解析>>
科目:高中化学 来源:2015-2016学年黑龙江大庆铁人中学高二下期末化学试卷(解析版) 题型:实验题
乙酸环己酯具有香蕉及苹果气味,主要用于配制各种饮料、冰淇淋等,实验室制备乙酸环己酯的反应装置示意图和有关数据如下:
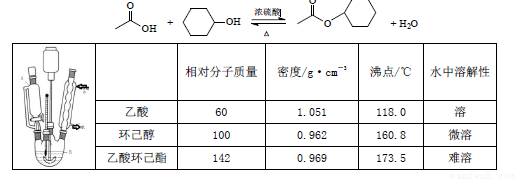
实验步骤:
将12.0g(0.2mol)乙酸、10.0g(0.1mol)环已醇和15mL 环已烷加入装有温度计、恒压滴液漏斗和球形冷凝管的四颈烧瓶中,在搅拌下,慢慢滴加15mL98% 浓硫酸,恒 压滴液漏斗换成分水器装置,加热回流90min,将反应液依次加水、10%的NaHCO3 溶液、水洗涤,然后加无水MgSO4,放置过夜,加热蒸馏, 收集168~174℃的馏
压滴液漏斗换成分水器装置,加热回流90min,将反应液依次加水、10%的NaHCO3 溶液、水洗涤,然后加无水MgSO4,放置过夜,加热蒸馏, 收集168~174℃的馏 分,得到无色透明有香味的液体,得产品6.9g
分,得到无色透明有香味的液体,得产品6.9g
(1)上述反应装置图中存在的一处错误是___________。
(2)实验中控制乙酸的物质的量是环已醇的2 倍,其目的是___________。
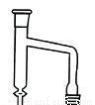
(3)使用分水器(如图)的目的是___________ 。
(4)用10%的NaHCO3溶液目的是___________;第二次水洗 的目的是___________ ;加入无水MgSO4 的目的是 ___________。
;加入无水MgSO4 的目的是 ___________。
(5)本次实验产率为___________。
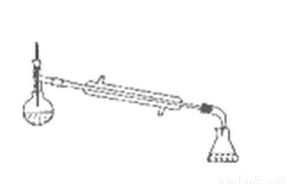
(6)若在进行蒸馏操作时,采用右图装置,会使实验的产率 (填“偏高”“ 偏低”“无影响”), 其原因是_________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com