
【题目】二氧化碳减排和再利用技术是促进工业可持续发展和社会环保的重要措施。将工业废气中的二氧化碳转化为甲醇,其原理是:
CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=a kJ·mol1
H2O(g)+CH3OH(g) ΔH=a kJ·mol1
2H2(g)+O2(g)=2H2O(l) ΔH=b kJ·mol1
H2O(g)=H2O(l) ΔH=c kJ·mol1
(1)2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH =______kJ·mol1
(2)H2(g)+1/2O2(g)=1/2H2O(l)的过程如下图所示,H-O键的键能是______kJ·mol1。

(3)某化学兴趣小组用甲醇燃料电池来模拟铝制品表面“钝化”处理过程(装置如图甲所示)。a电极发生的电极反应方程式为______。实验结束后若硫酸溶液质量减少1.08 g,则石墨电极处生成的气体在标准状况下的体积为______L。

(4)一种Na-CO2二次电池装置如图乙所示,NaClO4溶于有机溶剂作为电解液,电池的总反应为3CO2+4Na![]() 2Na2CO3+C。充电时的阳极反应式为______。
2Na2CO3+C。充电时的阳极反应式为______。
(5)海水中含有大量的HCO3-,一种利用海水提取CO2的装置如图丙所示。结合方程式简述提取CO2的原理:______。
【答案】3b-2a-2c 463.4 CH3OH-6e+H2O=CO2↑+6H+ 1.344 2CO32-+C-4e=3CO2 a室为阳极,电解水,失电子产生氧气和氢离子,电极方程式为:2H2O-4e—=4H++O2↑,H+通过阳离子膜进入海水,与碳酸氢根离子反应生成二氧化碳,发生反应:HCO3-+H+=CO2↑+H2O
【解析】
(1)已知①CO2(g)+3H2(g)![]() H2O(g)+CH3OH(g) ΔH=a kJ·mol1
H2O(g)+CH3OH(g) ΔH=a kJ·mol1
②2H2(g)+O2(g)=2H2O(l) ΔH=b kJ·mol1
③H2O(g)=H2O(l) ΔH=c kJ·mol1
根据盖斯定律,②×3-①×2-③×2,可得2CH3OH(g)+3O2(g)=2CO2(g)+4H2O(l) ΔH =3b kJ·mol1- 2a kJ·mol1-2c kJ·mol1=(3b-2a-2c)kJ·mol1;
答案为:3b-2a-2c。
(2)根据图示:H2(g)+![]() O2(g)=2 H (g)+O(g) ΔH1=+685 kJ·mol1,2 H (g)+O(g)= H2O(g) ΔH2,H2O(g)= H2O(l) ΔH3=-44 kJ·mol1,H2(g)+
O2(g)=2 H (g)+O(g) ΔH1=+685 kJ·mol1,2 H (g)+O(g)= H2O(g) ΔH2,H2O(g)= H2O(l) ΔH3=-44 kJ·mol1,H2(g)+![]() O2(g)= H2O(l) ΔH4=-285.8 kJ·mol1;根据盖斯定律,结合图示可得:ΔH1+ΔH2+ΔH3=ΔH4,即685 kJ·mol1+ΔH2+(-44 kJ·mol1)=(-285.8 kJ·mol1),则ΔH2=-926.8 kJ·mol1,H-O键的键能是
O2(g)= H2O(l) ΔH4=-285.8 kJ·mol1;根据盖斯定律,结合图示可得:ΔH1+ΔH2+ΔH3=ΔH4,即685 kJ·mol1+ΔH2+(-44 kJ·mol1)=(-285.8 kJ·mol1),则ΔH2=-926.8 kJ·mol1,H-O键的键能是![]() ×926.8 kJ·mol1=463.4 kJ·mol1,
×926.8 kJ·mol1=463.4 kJ·mol1,
答案为:463.4。
(3)用甲醇燃料电池来模拟铝制品表面“钝化”处理,则铝为电解池阳极,失电子发生氧化反应,变为氧化铝和氢离子,石墨为电解池阴极,氢离子得到电子转化为氢气,则b为原电池正极,a为原电池负极;燃料电池中燃料在负极发生反应,故a电极发生的电极反应方程式为CH3OH-6e+H2O=CO2↑+6H+;电解池中,阳极反应式为3H2O +2Al -6e-= Al2O3+6H+,阴极电极式为6H++6e-= 3H2↑,根据电极反应,硫酸溶液质量减少1.08 g为水的质量,3H2O~3H2,则产生的氢气的物质的量=消耗水的物质的量=![]() mol,标况下的体积为
mol,标况下的体积为![]() mol×22.4L/mol=1.344L。
mol×22.4L/mol=1.344L。
答案为:1.344。
(4)根据电池的总反应3CO2+4Na![]() 2Na2CO3+C,充电时,阳极失电子,根据反应方程式,2CO32-+C-4e=3CO2,
2Na2CO3+C,充电时,阳极失电子,根据反应方程式,2CO32-+C-4e=3CO2,
答案为:2CO32-+C-4e=3CO2。
(5)a室为阳极,电解水,失电子产生氧气和氢离子,电极方程式为:2H2O-4e—=4H++
答案为:a室为阳极,电解水,失电子产生氧气和氢离子,电极方程式为:2H2O-4e—=4H++O2↑,H+通过阳离子膜进入海水,与碳酸氢根离子反应生成二氧化碳,发生反应:HCO3-+H+=CO2↑+H2O。


 愉快的寒假南京出版社系列答案
愉快的寒假南京出版社系列答案科目:高中化学 来源: 题型:
【题目】铝是应用广泛的金属。以铝土矿(主要成分为Al2O3,含SiO2和Fe2O3等杂质)为原料制备铝的一种工艺流程如下:

注:SiO2在“碱溶”时转化为铝硅酸钠沉淀。
(1)“碱溶”时生成偏铝酸钠的离子方程式为_____________________。
(2)向“过滤Ⅰ”所得滤液中加入NaHCO3溶液,溶液的pH_________ (填“增大”、“不变”或“减小”)。
(3)“电解Ⅰ”是电解熔融Al2O3,电解过程中作阳极的石墨易消耗,原因是___________。
(4)“电解Ⅱ”是电解Na2CO3溶液,原理如图所示。阳极的电极反应式为_____________________,阴极产生的物质A的化学式为____________。

(5)铝粉在1000℃时可与N2反应制备AlN。在铝粉中添加少量NH4Cl固体并充分混合,有利于AlN的制备,其主要原因是_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某反应由两步反应A![]() B
B![]() C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )
C构成,它的反应能量曲线如图所示(E1、E2、E3、E4表示活化能)。下列有关叙述不正确的是( )
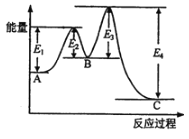
A. A→C的反应为放热反应 B. 稳定性C>A>B.
C. A→C的反应中,△H=(E2+E4)-(E1+E3) D. 加入催化剂不会改变反应的焓变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知化合物 A 由两种元素组成,某研究小组按如图流程探究其组成,其中 D 是一种能使品红溶液褪色的气体。
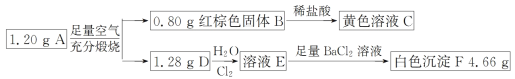
请回答下列问题:
(1)化合物 A 的组成元素有______。(填元素符号)
(2)写出 A→B+D 的化学方程式_________。
(3)写出 D→E 的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】40℃,向体积为VL的密闭容器中充入NO,容器内各组分的物质的量随时间变化曲线如图所示。下列说法正确的是

A.X是N2O
B.1 min~3 min时,v(NO2)=1/6Vmol·(L·min)-1
C.40℃时该反应的平衡常数为1
D.NO2和X的浓度相等可以作为判断反应到达平衡的标志
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高锰酸钾是中学化学常用的试剂。主要用于防腐、化工、制药等。实验室模拟工业上用软锰矿制备高锰酸钾的流程如下:
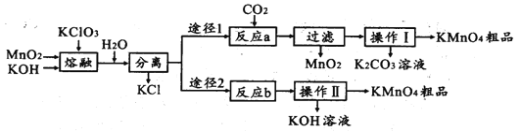
(1)实验室熔融二氧化锰、氧氧化钾、氯酸钾时应选择____________________________
a.普通玻璃坩埚 b.石英坩埚 c.陶瓷坩埚 d.铁坩埚
(2)第一步熔融时生成K2MnO4的化学方程式:______________________________________
(3)操作Ⅰ中根据KMnO4和K2CO3两物质在____________ (填性质)上的差异,采用浓缩结晶、趁热过滤得到KMnO4。趁热过滤的原因是______________________________________
(4)反应b是电解法制备KMnO4,其装置如图所示,a作____________极(填“阳”或“阴”),中间的离子交换膜是_____ (填“阳”或“阴”)离子交换膜。阳极的电极反应式为____________
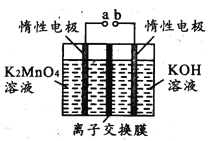
(5)取反应b后的电解液,加硫酸溶解后,用0.1000mol ·L-1FeSO4标准溶液滴定至终点时,消耗250.0mL标准溶液,则电解后溶液中的KMnO4的质量是_________g。
(6)两种途径的制备方法,途径1与途径2理论产率之比为_________
(7)KMnO4稀溶液是一种常用的消毒剂。其消毒原理与下列物质相同的是________(填标号)。
a.双氧水 b.84消液(NaClO溶液) c.75%酒精 d.苯酚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究一溴环己烷(![]() )与NaOH的醇溶液共热发生的是水解反应还是消去反应,下列四位同学分别设计如下实验方案,其中判断正确的是
)与NaOH的醇溶液共热发生的是水解反应还是消去反应,下列四位同学分别设计如下实验方案,其中判断正确的是
A. 向反应混合液中滴入稀硝酸中和NaOH溶液,然后滴入AgNO3溶液,若有浅黄色沉淀生成,则可证明发生了消去反应。
B. 向反应混合液中滴入溴水,若溶液颜色很快褪去,则可证明发生了消去反应。
C. 向反应混合液中滴入酸性KMnO4溶液,若溶液颜色变浅,则可证明发生了消去反应
D. 向反应混合液中先加盐酸酸化,再加入溴水,如果溶液颜色很快退去,则证明发生了消去反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,向10 mL 0.1 mol·L-1 CuCl2溶液中滴加0.1 mol·L-1的Na2S溶液,滴加过程中溶液中-lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,下列有关说法正确的是(已知:lg 2=0.3,Ksp(ZnS)=3×10-25)
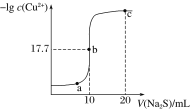
A.a、b、c三点中,水的电离程度最大的为b点
B.Na2S溶液中:c(S2-)+c(HS-)+c(H2S)=2c(Na+)
C.该温度下Ksp(CuS)=4×10-36
D.向100 mL Zn2+、Cu2+浓度均为10-5mol·L-1的混合溶液中逐滴加入10-4 mol·L-1的Na2S溶液,Zn2+先沉淀
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com