

 2NH3 (g) ΔH<0,
2NH3 (g) ΔH<0,| T /K | 298 | 398 |
| 平衡常数K | K1 | K2 |

 NH4++OH- (其他合理答案也给分) (2分)
NH4++OH- (其他合理答案也给分) (2分) 2NH3(g)△H<0,反应是放热反应,温度升高平衡逆向进行,平衡常数减小,所以K1>K2,故答案为:>;
2NH3(g)△H<0,反应是放热反应,温度升高平衡逆向进行,平衡常数减小,所以K1>K2,故答案为:>; NH4++OH-,故答案为:NH3·H2O
NH4++OH-,故答案为:NH3·H2O NH4++OH-;
NH4++OH-;

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:填空题
 CH3OH(g) △H= -90.8kJ/mol
CH3OH(g) △H= -90.8kJ/mol CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol CO2(g)+H2(g) △H=-41.3kJ/mol
CO2(g)+H2(g) △H=-41.3kJ/mol CH3OCH3(g)+CO2(g) 的△H= ;
CH3OCH3(g)+CO2(g) 的△H= ; CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol
CH3OCH3(g)+H2O(g) △H=-23.5kJ/mol| 物质 | CH3OH | CH3OCH3 | H2O |
| 浓度(mol·L-1) | 0.40 | 0.6 | 0.6 |
 _________
_________ (填“>”、“<”或“=”)。
(填“>”、“<”或“=”)。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入8mol N2和9molO2,5min后达平衡时NO物质的量为6mol,计算该条件下的平衡常数(写出计算过程)。 2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
2CO2(g)+ N2(g) 中NO的浓度随温度(T)、催化剂表面积(S)和时间(t)的变化曲线,据此判断该反应的△H 0 (填“>”、“<”或“无法确定”)。若催化剂的表面积S1>S2 ,在图中画出NO的浓度在T1、S2 条件下达到平衡过程中的变化曲线,并注明条件。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
2NH3(g) △H。下图I是合成氨反应的能量与反应过程相关图(未使用催化剂);图D是合成気反应在2L容器中、相同投料情况下、其它条件都不变时,某一反应条件的改变对反应的影响图。
| A.ΔH=-92.4kJ/mol |
| B.使用催化剂会使E1的数值增大 |
| C.为了提高转化率,工业生产中反应的浓度越低越好 |
| D.图II是不同压强下反应体系中氨的物质的量与反应时间关系图,且PA<PB |
 mol/(L·min)
mol/(L·min) 倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______
倍,则此温度下的平衡常数为_______。在同一温度,同一容器中,将起始物质改为amol N2 b molH2 c mol NH3 (a,b,c均不为零)欲使平衡混合物中各物质的质量与原平衡相同,则a,b,c满足的关系为_____________(用含a,b,c的表达式表示),且欲使反应在起始时向逆反应方向进行,c的取值范围是_______查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.常温常压下单斜硫比正交硫稳定 |
B.单斜硫转变为正交硫的能量变化可用下图表示 |
| C.S(g)+O2(g)→SO2(g)+Q3 Q3>296.83kJ |
| D.反应①中生成1 L SO2 (g)放出297.16kJ热量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:计算题

 CH3OH(g) △H=QkJ/mol
CH3OH(g) △H=QkJ/mol ( CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q_____0(填“>”“<”或“=”);
( CH3OH)与反应温度T的关系曲线如图2所示,则上述反应的Q_____0(填“>”“<”或“=”);查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
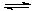 H++ SO42-
H++ SO42- 的废水会发生如下反应:
的废水会发生如下反应: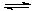 Mg(OH)2 Mg(OH)2+2NH4+
Mg(OH)2 Mg(OH)2+2NH4+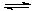 Mg2+ +2NH3·H2O。
Mg2+ +2NH3·H2O。
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 2SO3(g) ?H=-196.6 kJ·mol-1
2SO3(g) ?H=-196.6 kJ·mol-1 2NO2(g) ?H=-113.0 kJ·mol-1
2NO2(g) ?H=-113.0 kJ·mol-1  SO3(g)+NO(g)的?H= kJ·mol-1。
SO3(g)+NO(g)的?H= kJ·mol-1。

 CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。
CH3OH(g)。CO在不同温度下的平衡转化率与压强的关系如上图(右)所示。该反应?H 0(填“>”或“ <”)。 查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 O2(g)=ZnO(s) △H =-351.1kJ·mol-1
O2(g)=ZnO(s) △H =-351.1kJ·mol-1 O2(g)=HgO(s) △H =-90.7 kJ·mol-1
O2(g)=HgO(s) △H =-90.7 kJ·mol-1| A.-260.4 kJ·mol-1 | B.-441.8 kJ·mol-1 |
| C.260.4 kJ·mol-1 | D.441.8 kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com