
| A、上述钛原子中,中子数不可能为22 | B、钛元素在周期表中处于第四周期 | C、钛的各种同位素在周期表中处于不同的位置 | D、钛的各种同位素化学性质几乎相同 |


科目:高中化学 来源: 题型:
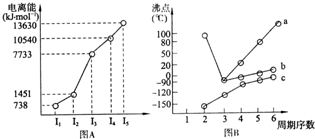
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解

 化合
化合查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源:2010年黑龙江省高一下学期期中考试化学试题 题型:选择题
金属钛(22Ti)对人体无毒且惰性,能与肌肉和骨骼生长在一起,有“生物金属”之称。下列关于48Ti和50Ti及钛元素的说法正确的是
A.原子核外M层都有12个电子 B.钛元素不是主族元素
C.钛元素的相对原子质量必为49 D.48Ti和50Ti为同一核素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com