
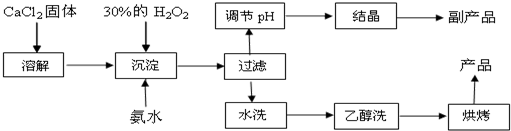
分析 (1)“溶解”过程需要的玻璃仪器为烧杯、玻璃棒;为了控制沉淀温度为0℃左右,在实验室宜采取的方法是冰水浴冷却可以达到实验目的;根据检验水洗后没有Cl-离子的方法判断合格;
(2)实验的目的为制备CaO2•8H2O,则流程中的沉淀应为CaO2•8H2O,根据质量守恒判断还应有NH4Cl生成,根据质量守恒定律可写出反应的离子方程式;由方程式得n(H2O2)=n(CaCl2)计算;
(3))①CaO2具有强氧化性,溶液中加入KI晶体和淀粉溶液,生成的碘单质遇淀粉变蓝色,据此分析;
②根据反应的离子方程式,CaO2+4H++2I-═Ca2++2H2O+I2,I2+2S2O32-→2I-+S4O62-,可得关系式CaO2~2S2O32-,并以此进行计算;
③根据空气中的氧气能够氧化碘离子,使碘单质的量增加,消耗的硫代硫酸钠增加分析.
解答 解:(1)“溶解”过程需要的玻璃仪器为烧杯、玻璃棒;为了控制沉淀温度为0℃左右,在实验室宜采取的方法是冰水浴冷却可以达到实验目的,比较简单易行的方法是将反应容器浸入冰水中;为检验“水洗”是否合格,检验水洗后没有Cl-离子即可,则可取少量洗涤液于试管中,再滴加 AgNO3溶液,无明显现象说明“水洗”合格;故答案为:烧杯、玻璃棒;将反应容器浸入冰水中;AgNO3溶液;
(2)本实验的目的为制备CaO2•8H2O,则流程中的沉淀应为CaO2•8H2O,根据质量守恒判断还应有NH4Cl生成,故反应的离子方程式为:Ca2++2NH3•H2O+H2O2+6H2O=CaO2•8H2O↓+2NH4+;副产品为NH4Cl;
由方程式得n(H2O2)=n(CaCl2),所以设量取质量分数30%、密度1.1g/cm3的H2O2溶液xmL,则有$\frac{11.1g}{111g/mol}$=$\frac{1.1x×30%g}{34g/mol}$,解得x=10.3ml
故答案为:Ca2++2NH3•H2O+H2O2+6H2O=CaO2•8H2O↓+2NH4+;NH4Cl;10.3;
(3)①CaO2具有强氧化性,溶液中加入KI晶体和淀粉溶液,生成的碘单质遇淀粉变蓝色,反应的离子方程式为:CaO2+4H++2I-═Ca2++2H2O+I2,所以反应恰好完全的现象是溶液由蓝色变为无色,且30s不恢复,故答案为:溶液由蓝色变为无色,且30s不恢复;
②根据反应的离子方程式,CaO2+4H++2I-═Ca2++2H2O+I2,I2+2S2O32-→2I-+S4O62-,可得关系式并以此进行计算:
CaO2~2S2O32-
72g 2mol
m cV×10-3mol
m=$\frac{72g×cV×10-3mol}{2mol}$=36cV×10-3g
则CaO2的质量分数为$\frac{36cV×10{\;}^{-3}}{a}$
故答案为:$\frac{36cV×10{\;}^{-3}}{a}$;
③在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高,
故答案为:偏高;在酸性条件下空气中的O2也可以把KI氧化为I2,使消耗的Na2S2O3增多,从而使测得的CaO2的质量分数偏高
点评 本题考查形式为物质制备流程图题目,涉及物质的化学方程式的书写,实验方法和实验操作、物质的检验和计算等问题,做题时注意分析体重关键信息,掌握实验基本操作等问题,本题较为综合.


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 试管a中试剂 | 试管b中试剂 | 测得有机层的厚度/cm |
| A | 3mL乙醇、2mL乙酸、1mL18mol•L-1 浓硫酸 | 饱和Na2CO3溶液 | 5.0 |
| B | 3mL乙醇、2mL乙酸 | 0.1 | |
| C | 3mL乙醇、2mL乙酸、6mL 3mol•L-1 H2SO4 | 1.2 | |
| D | 3mL乙醇、2mL乙酸、盐酸 | 1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
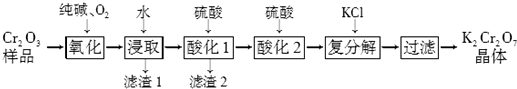
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
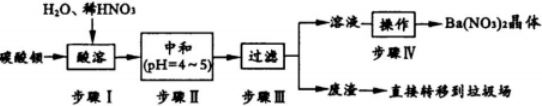
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①⑤ | B. | ③④ | C. | ② | D. | 全都不行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com