
| A、c(A-)>c(Na+) |
| B、c(HA)<c(A-) |
| C、c(Na+)>c(OH-) |
| D、c(HA)+c(A-)=0.1 mol/L |


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
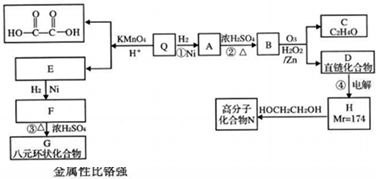
| KMnO4/H+ |
| O3 |
| H2O2/Zn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在一定温度和压强下,各种气态物质体积大小由分子间距离决定 |
| B、相同温度时,CO2和N2O若体积相同,则它们的质量一定相同 |
| C、100g浓度为18mol/L的浓硫酸中加入等质量的水稀释浓度大于9mol/L |
| D、14 mol/L的H2SO4溶液的溶质质量分数为80%,那么7 mol/L的H2SO4溶液的溶质质量分数将大于40% |
查看答案和解析>>
科目:高中化学 来源: 题型:
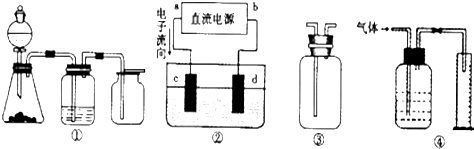
 二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:
二氧化硫是造成大气污染的主要有害气体之一,某合作学习小组的同学拟测定某地大气中SO2的含量,实验步骤及装置如图:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源.目前分解水制氢气的工业制法之一是“硫-碘循环”,主要涉及下列反应:
氢能被视为未来的理想清洁能源,科学家预测“氢能”将是21世纪最理想的新能源.目前分解水制氢气的工业制法之一是“硫-碘循环”,主要涉及下列反应:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用酸式滴定管量取25.00mL溴水 |
| B、不宜用瓷坩埚熔融氢氧化钠或碳酸钠 |
| C、测定溶液的pH时用干燥、洁净的玻璃棒蘸取溶液,滴在用蒸馏水湿润过的pH试纸上,再与标准比色卡比较 |
| D、圆底烧瓶、锥形瓶、烧杯加热时都应垫在石棉网上 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| t℃ | 373 | 473 | 573 | 673 | 773 |
| K | 3.35×109 | 1.00×107 | 2.45×105 | 1.88×104 | 2.99×103 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com