
下列反应不能用离子方程式:CO32﹣+2H+=CO2↑+H2O表示的是( )
|
| A. | Na2CO3+2HCl=2NaCl+CO2↑+H2O |
|
| B. | K2CO3+2HNO3=2KNO3+CO2↑+H2O |
|
| C. | K2CO3+H2SO4=K2SO4+CO2↑+H2O |
|
| D. | CaCO3+2HCl=CaCl2+H2O+CO2↑ |
考点:
离子方程式的书写.
专题:
离子反应专题.
分析:
离子反应的实质是代表一类反应,可溶性碳酸盐与强酸反应生成可溶性盐、水、二氧化碳的离子反应可用CO32﹣+2H+═CO2+H2O表示,否则不能,以此来解答.
解答:
解:A.碳酸钠是易溶于水的盐,盐酸是强酸,二者之间发生反应的实质是:CO32﹣+2H+=CO2↑+H2O,故A不选;
B.K2CO3+2HNO3═2KNO3+CO2+H2O为可溶性碳酸盐与强酸反应生成可溶性盐的化学反应,反应的实质是:CO32﹣+2H+=CO2↑+H2O,故B不选;
C.K2CO3+H2SO4═K2SO4+CO2+H2O为可溶性碳酸盐与强酸反应生成可溶性盐的化学反应,反应的实质是:CO32﹣+2H+=CO2↑+H2O,故C不选;
D.碳酸钙是难溶于水的盐,在离子反应方程式中应该写化学式,所以CaCO3+2HCl═CaCl2+H2O+CO2的离子反应为CaCO3+2H+═CO2+H2O+Ca2+,故D选;
故选D.
点评:
本题考查化学反应与离子反应方程式的关系,明确发生的化学反应及酸碱的强弱及盐的溶解性和离子反应方程式的书写方法是解答的关键,题目难度不大.


科目:高中化学 来源: 题型:
工业上以硫铁矿为原料制硫酸所产生的尾气除了含有N2、O2外,还含有SO2、微量的SO3和酸雾。为了保护环境,同时提高硫酸工业的综合经济效益,应尽可能将尾气中的SO2转化为有用的副产品。请按要求回答下列问题:
(1)将尾气通入氨水中,能发生多个反应,写出其中可能发生的两个氧化还原反应的化学方程式: 、 。
(2)在尾气与氨水反应所得到的高浓度溶液中,按一定比例加入氨水或碳酸氢铵,此时溶液的温度会自行降低,并析出晶体。①导致溶液温度降低的原因可能是 ;②析出的晶体可用于造纸工业,也可用于照相用显影液的生产。已知该 结晶水合物的相对分子质量为134,则其化学式为 ;③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是 。
结晶水合物的相对分子质量为134,则其化学式为 ;③生产中往往需要向溶液中加入适量的对苯二酚或对苯二胺等物质,其目的是 。
(3)能用于测定硫酸尾气中SO2含量的是 。(填字母)
A.NaOH溶液、酚酞试液 B.KMnO4溶液、稀H2SO4
C.碘水、淀粉溶液 D.氨水、酚酞试液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式,错误的是( )
|
| A. | 铁跟稀硫酸反应:2Fe+6H+=2Fe3++3H2 |
|
| B. | 碳酸钙与盐酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
|
| C. | 铁投入硫酸铜溶液中:Fe+Cu2+═Cu+Fe2+ |
|
| D. | KHCO3溶液中滴加H2SO4溶液:HCO3﹣+H+=H2O+CO2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质中氧原子数目与93g Na2O中氧原子数一定相等的是( )
|
| A. | 67.2L CO2 | B. | 33g CO2 | C. | 80g SO3 | D. | 98g H2SO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、B、C、D为原子序数依次增大的前四周期元素,元素A基态原子核外有3个未成对电子,元素B原子最外层电子数是内层电子数的3倍,元素C的最高价和最低价代数和等于0,元素D位于周期表ⅥB族。
(1)判断离子AB 的空间构型为________。
的空间构型为________。
(2)元素A、C形成的化合物熔点高,但比B、C形成的化合物熔点低,其原因是 。
 (3)在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是________。
(3)在A的氢化物(A2H4)分子中,A原子轨道的杂化类型是________。
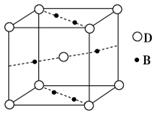
(4)元素B与D形成的一种化合物广泛应用于录音磁带上,
其晶胞如右图所示。该化合物的化学式为________。
(5)向D的氯化物DCl3溶液中滴加氨水可形成配合Cl
①D原子的外围电子排布式为________。
②1 mol该配合物中含配位键的数目为________。
(6) D元素以D2O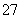 的形式存在于酸性废水中,常用FeSO4将其还原为D3+,写出该反应的离子方程式为___________________________________________。
的形式存在于酸性废水中,常用FeSO4将其还原为D3+,写出该反应的离子方程式为___________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com