
| A. | Na+、K+、HCO3- | B. | NH4+、Al3+、SO42- | C. | Na+、AlO2-、NO3- | D. | Cu2+、SO42-、Cl- |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 氯化镁晶体需在氯化氢气流的氛围中加热失水制得无水氯化镁 | |
| B. | 夏天,打开碳酸饮料会有较多气泡溢出 | |
| C. | 实验室中常用排饱和食盐水的方法收集氯气 | |
| D. | 工业上生产氨气时,采用高温和催化剂等条件 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 不慎将浓碱溶液沾到皮肤上,立即用大量硫酸冲洗,然后再用水冲洗 | |
| B. | 不慎将酸溅到眼中,立即用大量水冲洗,边洗边眨眼睛 | |
| C. | 实验时手指上不小心沾上浓硫酸,立即用NaOH溶液清洗 | |
| D. | 酒精不慎洒在实验桌上烧起来时,立即用水浇灭 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
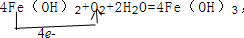 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| B. | 向CuSO4溶液中加入NaOH:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 在酸性溶液中,KIO3与KI反应生成I2:IO3-+I-+6H+═I2+3H2O | |
| D. | 向Al2(SO4)3溶液中加入过量的NH3?H2O2:Al3++4NH3?H2O2═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
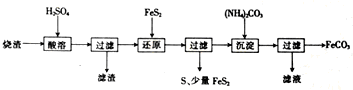
| 离子 | 离子浓度(mol?L-1) | |
| 还原前 | 还原后 | |
| Fe2+ | 0.10 | 2.50 |
| SO42- | 3.50 | 3.70 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
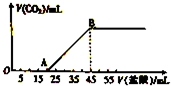 将5.08g由Na2CO3和NaHCO3组成的固体混合物完全溶于水,制成溶液,然后向该溶液中逐滴加入2mol?L-1的盐酸,所加入盐酸的体积与产生CO2体积(标准状况)的关系如图所示.
将5.08g由Na2CO3和NaHCO3组成的固体混合物完全溶于水,制成溶液,然后向该溶液中逐滴加入2mol?L-1的盐酸,所加入盐酸的体积与产生CO2体积(标准状况)的关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
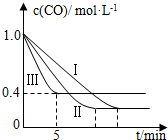 利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.
利用甲烷与水反应制备氢气,因原料廉价产氢率高,具有实用推广价值.| 编号 | 温度 | 压强 | c始(CO) | c始(H2O) |
| Ⅰ | 530℃ | 3MPa | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅱ | X | Y | 1.0mol•L-1 | 3.0mol•L-1 |
| Ⅲ | 630℃ | 5MPa | 1.0mol•L-1 | 3.0mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com