
| ||
| A、增加铁的量 |
| B、将容器体积缩小一半 |
| C、升高温度 |
| D、压强不变,充入N2使容器体积增大 |


科目:高中化学 来源: 题型:
| A、HCO3-+H2O?H3O++CO32- |
| B、Fe3++3H2O?Fe(OH)3+3H+ |
| C、HS-+H2O?H2S+OH- |
| D、HCOOH+H2O?HCOO-+H3O+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氯气和二氧化硫使品红溶液褪色 |
| B、常温下,可以用铝制容器贮藏浓硫酸和浓硝酸 |
| C、浓硫酸和浓盐酸暴露在空气中浓度均减小 |
| D、氯化铵和碘都可以用加热法进行提纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、SO42- Na+Fe3+ Cl- |
| B、Ba2+ Na+Cl- SO42- |
| C、HCO3-K+ SO42-OH- |
| D、Ag+ Al3+ NO3-H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、50mL 1.5mol/L 蔗糖溶液 |
| B、100mL 1.0mol/L 醋酸溶液 |
| C、50mL 0.5mol/L AlCl3溶液 |
| D、100mL 0.5mol/L MgCl2溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、H2(g)的消耗速率与HI(g)的生成速率之比为2:1 |
| B、正、逆反应速率的比值是恒定的 |
| C、当HI的分子数与I2分子数之比为2:1时,说明反应达到了平衡状态 |
| D、达到平衡时,正、逆反应速率相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、3.165g |
| B、3.105g |
| C、4.255g |
| D、5.625g |
查看答案和解析>>
科目:高中化学 来源: 题型:
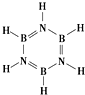 元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点.
元素周期表中,金属和非金属分界线附近的元素性质特殊,其单质及化合物应用广泛,成为科学研究的热点.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、锌是负极,氧化银是正极 |
| B、锌发生还原方应,氧化银发生氧化反应 |
| C、溶液中OH-向正极移动,K+、H+向负极移动 |
| D、在电池放电过程中,电解质溶液的酸碱性基本保持不变 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com