
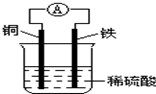
| A. | 铜棒逐渐溶解 | |
| B. | 该装置能将电能转化为化学能 | |
| C. | 负极反应式为Fe-2e-=Fe2+,发生还原反应 | |
| D. | 电子由铁棒通过导线流向铜棒 |
科目:高中化学 来源: 题型:选择题
| A. | 晶体硅的网状结构中,由共价键形成的硅原子环中,最小的环上有6个硅原子 | |
| B. | 氯化铯晶体中,Cs+的配位数为8 | |
| C. | 氯化钠晶体中,每个Cl-周围距离相等且最近的Cl-有6个 | |
| D. | 干冰晶体中,每个CO2分子周围距离相等且最近的CO2分子有12个 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| E | A | |||
| B | C | D |
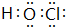 .A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.
.A在与氢元素形成的化合物中,含有非极性键的化合物的结构式为H-O-O-H.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 部分难溶物的颜色和常温下的Ksp如下表所示:
部分难溶物的颜色和常温下的Ksp如下表所示:| Cu(OH)2 | CuOH | CuCl | Cu2O | |
| 颜色 | 蓝色 | 黄色 | 白色 | 砖红色 |
| Ksp(25℃) | 1.6×10-19 | 1.0×10-14 | 1.2×10-6 | - |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
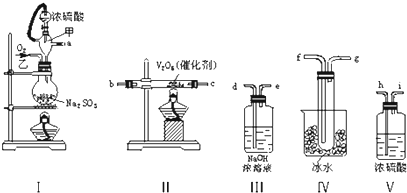
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为防止铁生锈,在其表面涂一层防锈油漆 | |
| B. | 为防止火灾,在面粉厂、加油站等场所要严禁烟火 | |
| C. | 为加快H2O2的分解速率,把反应容器放到冷水中冷却 | |
| D. | 为加快KClO3的分解速率,加入MnO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
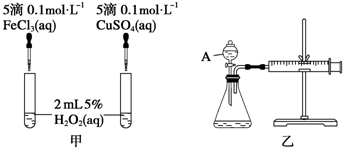
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
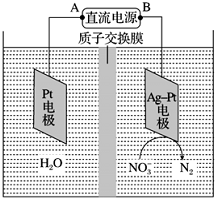 电化学降解NO3-的原理如图所示.
电化学降解NO3-的原理如图所示.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com