
 知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X能互换)不可能是( )
知甲、乙、丙、X是4种中学化学中常见的物质,其转化关系符合下图。则甲和X(要求甲和X能互换)不可能是( ) 
| A.C和O2 | B.SO2 和NaOH溶液 |
| C.Cl2和Fe | D.AlCl3溶液和NaOH溶液 |
 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源:不详 题型:单选题
| A.原子半径:W> Y> X |
| B.元素X与M形成化合物的空间构型可以是正四面体型、直线型或平面型等 |
| C.将X Z2通入W单质与水反应后的溶液中,生成的盐一定只有一种 |
| D.Y元素的含氧酸都属于强酸 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题

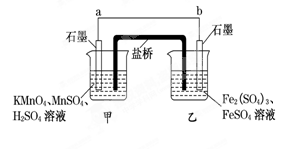
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 ,1个
,1个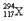 。下列关于
。下列关于 和
和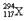 的说法,不正确的是
的说法,不正确的是| A.是两种核素 | B.互为同位素 |
| C.中子数分别为176和177 | D.电子数相差1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 ,试回答:
,试回答:查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
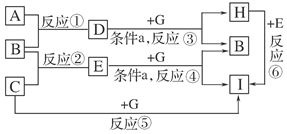
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题

| A.X的气态氢化物比Y的稳定 | B.X与Y形成的化合物都易溶于水 |
| C.Z的非金属性比Y的弱 | D.原子半径:X>Y>Z>W |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 (1)W的第一电离能比氧原子的 (填“大”或“小”),W的气态氢化物稳定性比
(1)W的第一电离能比氧原子的 (填“大”或“小”),W的气态氢化物稳定性比 H2O(g) (填“强”或“弱”),W的单质分子中含 个∏键;
H2O(g) (填“强”或“弱”),W的单质分子中含 个∏键; (2)Z位于元素周期表第 周期第 族,Z的基态原子核外电子排布式是 ;
(2)Z位于元素周期表第 周期第 族,Z的基态原子核外电子排布式是 ; (3)X、Y的最高价氧化物对应水化物相互反应的离子方程式是
(3)X、Y的最高价氧化物对应水化物相互反应的离子方程式是查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
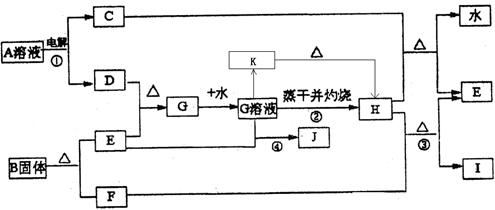
 则样品中G的质量分数为: 。
则样品中G的质量分数为: 。查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com