
【题目】氯气是一种重要的化工原料,在工农业生产生活中有着重要的应用。某化学兴趣小组同学利用以下装置制备氯气并对氯气的性质进行探究:
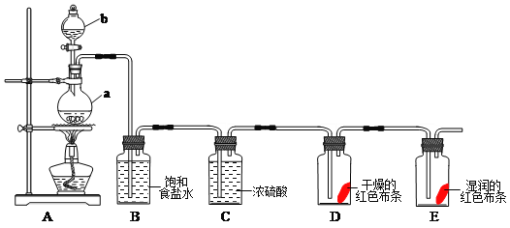
(1)有关氯气、氯水和氯离子的性质,下列说法正确的是_____________
A.氯水的颜色呈浅黄绿色,说明氯水中含有Cl2
B.Cl-和Cl2都具有很强的氧化性
C.新制氯水可以用来杀菌消毒是因为生成强酸 次氯酸
D.将新制氯水滴入AgNO3溶液,会出现白色沉淀
(2)仪器a的名称为___________,装置B中饱和食盐水的作用是_______________。
(3)装置A中发生反应的离子方程式为:____________________________________。
(4)装置D中的实验现象为__________________,装置E中的实验现象为________
(5)整套实验装置存在着明显缺陷,你的改进措施是__________________________。
(6)8.7gMnO2固体与足量浓盐酸充分反应,在标准状况下产生Cl2的体积为_____L;其中被氧化的HCl的物质的量为_______mol。
【答案】AD 圆底烧瓶 除去Cl2中的HCl气体 MnO2 + 4H+ + 2Cl-![]() Mn2+ + Cl2↑+2H2O 红色布条不褪色 红色布条褪色 在装置E后加一装有NaOH溶液的尾气处理装置 2.24 0.2
Mn2+ + Cl2↑+2H2O 红色布条不褪色 红色布条褪色 在装置E后加一装有NaOH溶液的尾气处理装置 2.24 0.2
【解析】
(1)根据氯气、氯水中的微粒以及氯离子的性质分析判断;
(2)根据仪器构造判断仪器名称,依据生成的氯气中含有的氯化氢分析判断;
(3)装置A制备氯气,据此书写方程式;
(4)根据氯气和次氯酸的性质分析判断;
(5)根据氯气有毒需要尾气处理分析判断;
(6)根据二氧化锰的质量结合反应的方程式计算。
(1)A.氯气是黄绿色气体,氯水的颜色呈浅黄绿色,说明氯水中含有Cl2,A正确;
B.Cl-中氯元素的化合价是-1价,处于最低价态,只有还原性;Cl2具有很强的氧化性,B错误;
C.新制氯水可以用来杀菌消毒是因为生成次氯酸,次氯酸是弱酸,C错误;
D.新制氯水中含有氯离子,将新制氯水滴入AgNO3溶液中生成氯化银,因此会出现白色沉淀,D正确;
答案选AD。
(2)根据仪器的构造可知仪器a的名称为圆底烧瓶;浓盐酸易挥发,生成的氯气中含有氯化氢,氯化氢极易溶于水,因此装置B中饱和食盐水的作用是除去Cl2中的HCl气体。
(3)实验室利用浓盐酸和二氧化锰在加热的条件下反应制备氯气,则装置A中发生反应的离子方程式为MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O。
Mn2++Cl2↑+2H2O。
(4)生成的氯气经过饱和食盐水除去氯化氢,利用浓硫酸干燥氯气,干燥的氯气没有漂白性,氯气和水反应生成的次氯酸具有漂白性,则装置D中的实验现象为红色布条不褪色,装置E中的实验现象为红色布条褪色。
(5)由于氯气是大气污染物,需要尾气处理,因此整套实验装置存在着明显缺陷,改进措施是在装置E后加一装有NaOH溶液的尾气处理装置。
(6)8.7gMnO2固体的物质的量是8.7g÷87g/mol=0.1mol,与足量浓盐酸充分反应,根据方程式可知在标准状况下产生Cl2的体积为0.1mol×22.4L/mol=2.24L;根据氯原子守恒可知生成0.1mol氯气,则其中被氧化的HCl的物质的量为0.2mol。


科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中粒子的物质的量浓度关系正确的是
A. 0.1 mol·L-1 Na2CO3与0.l mol·L-1 NaHCO3溶液等体积混合:2/3 c(Na+) = c(CO32-) + c(HCO3-) + c(H2CO3)
B. 0.1 mol·L-1 Na2C2O4与0.1 mol·L-1 HCl溶液等体积混合(H2C2O4为二元弱酸):2c(C2O42-)+c(HC2O4-)+c(OH-)=c(Na+)+c(H+)
C. 0.1 mol·L-1 CH3COONa与0.l mol·L-1 HCl 溶液等体积混合:c(Na+) = c(Cl-) > c(OH-) > c(CH3COO-)
D. 0.l mol·L-1 NH4Cl与0.l mol·L-1氨水等体积混合(pH > 7): c(NH3·H2O) > c(NH4+) > c(Cl-) > c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是
A. 22.4L CO2与足量Na2O2完全反应,转移电子数为2NA
B. 6.4 g 由S2、S4、S8组成的混合物含硫原子数为0.2NA
C. 1mol/L的NaCl溶液中Cl—的数目为NA
D. 标况下,22.4L NO和11.2L O2,混合后气体分子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某NaOH溶液中通入CO2气体后得到溶液M,因CO2通入的量不同,溶液M的组成也不同,若向溶液M中逐滴加入盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系如图所示。则下列分析与判断不正确的是(不计CO2溶解)
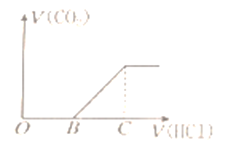
A. 若OB=0,则形成溶液的过程中所发生反应的离子方程式为OH―+CO2═HCO3―
B. 若OB=BC,则溶液M为Na2CO3溶液
C. 若OB>BC,则溶液M中大量存在的阴离子为CO32―和HCO3―
D. 若3OB=BC,则溶液M中c(NaHCO3)=2c(Na2CO3)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子在溶液中能大量共存的是( )
A.Mg2+、K+、OH﹣B.Ba2+、Na+、SO42﹣
C.K+、NH4+、OH﹣D.K+、Cu2+、NO3﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】臭氧氧化技术被广泛用于饮用水的处理,但也会产生易致癌的 BrO3-。
(1)取含 Br -的水样,向其中投加一定量的 H2O2 ,再经 O3氧化后,水中溴酸盐(BrO3-)的含量如图所示

①投加过氧化氢,其目的是___。
②未投加过氧化氢,臭氧投加量在 0~1.0 mg·L-1时,BrO3 -的浓度为 0 的可能原因是___ 。
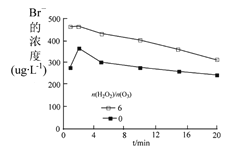
(2)科研小组在控制其他条件一定时,研究 n(H2O2)/n(O3) 对水样中 Br-浓度的影响,结果如图。在相同时刻,投加 H2O2 的反应中 Br-的浓度高于未投加 H2O2 的,其可能原因是反应过程中生成的HBrO 被 H2O2 还原所致,该反应的化学方程式为___ 。
(3)BrO3 -能被活性炭有效去除,其去除机理分为两步,第一步是___;第二步是 BrO3 -被活性炭还原为Br-。反应方程式(未配平)如下:
≡C+BrO3-→ BrO- + ≡CO2 ①
≡C+BrO-→ Br - + ≡CO2 ②
反应的总方程式为:2BrO3- + 3 ≡C = 2Br- + 3 ≡CO2。其中≡C 代表活性炭表面,≡CO2代表活性炭表面氧化物。则反应①与反应②中参加反应的≡C 物质的量之比为___ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电离平衡常数(用Ka表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式 | HF | H2CO3 | H2S |
电离平衡常数 (Ka) | 7.2×10-4 | K1=4.4×10-7 K2=4.7×10-11 | K1=9.1×10-8 K2=1.1×10-12 |
(1)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l) ΔH=-67.7kJ/mol,
②H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ/mol,
氢氟酸电离的热化学方程式为________________________。
(2)将浓度为0.1 mol/L HF溶液加水稀释一倍(假设温度不变),下列各量增大的是____。
A.c(H+) B.c(H+)·c(OH-) C.![]() D.
D.![]()
(3)向Na2CO3溶液通入过量H2S,反应的离子方程式为______________。
(4)25℃时,在20mL 0.1mol/L氢氟酸中加入VmL 0.1mol/L NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_____________。
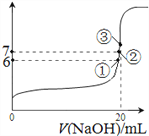
A.pH=3的HF溶液和pH=11的NaF溶液中, 由水电离出的c(OH-)相等
B.①点时pH=6,此时溶液中, c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)< c(Na+)=0.1mol/L
(5)Na2CO3溶液显碱性是因为CO32-水解的缘故,请设计简单的实验证明之:_______________________。
(6)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H-O-F。HFO与水反应得到HF和化合物A,每生成1mol HF转移________mol电子。
(7)已知BiCl3水解产物中有 BiOCl生成。写出水解反应方程式___________________________,为防止其水解,如何配制 BiCl3溶液?_________________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com