
【题目】绿矾是含有一定量结晶水的硫酸亚铁,在工农业生产中具有重要的用途。某化学兴趣小组对绿矾的一些性质进行探究。回答下列问题:
(1)在试管中加入少量绿矾样品,加水溶解,滴加KSCN溶液,溶液颜色无明显变化。再向试管中通入空气,产生的现象是___。
(2)为测定绿矾中结晶水含量,将带有两端开关K1和K2的石英玻璃管(设为装置A)称重,记为m1g,将样品装入石英玻璃管中,再次将装置A称重,记为m2g。按如图连接好装置进行实验。
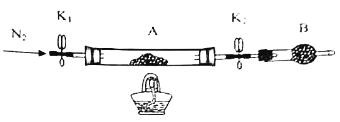
仪器B的名称是___。
②实验操作步骤:a.打开K1和K2,缓缓通入N2→b.点燃酒精灯,加热→c.熄灭酒精灯→d. →e.关闭K1和K2→f.称量A。d的操作为___。
③重复②的操作步骤,直至A恒重,记为m3g。根据实验记录,计算绿矾化学式中结晶水数目x=___(列式表示)。若实验时将a、b的操作次序颠倒,则使x___(填“偏大”“偏小”或“无影响”)。
(3)为探究硫酸亚铁的分解产物,将(2)中已恒重的装置A接入如图所示的装置中,打开K1和K2,缓缓通入N2,加热。实验后反应管中残留固体为红色粉末。

已知:装置C用于检验和吸收分解得到的气体产物之一——SO3。
①C、D中的溶液依次为___、___(填标号)。
a.品红 b.NaOH c.BaCl2 d.Ba(NO3)2 e.浓H2SO4
C、D中有气泡冒出,并可观察到的现象分别为___、___。
②写出硫酸亚铁高温分解反应的化学方程式:___。
③在方框中画出尾气吸收装置并注明所用试剂___。
【答案】溶液由浅绿色逐渐变为血红色 球形干燥管 待固体冷却至室温,停止通N2 ![]() 偏小 c a 有白色沉淀产生 品红溶液褪色 2FeSO4
偏小 c a 有白色沉淀产生 品红溶液褪色 2FeSO4![]() Fe2O3+SO2↑+SO3↑
Fe2O3+SO2↑+SO3↑ 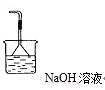
【解析】
(1)硫酸亚铁溶液中,滴加KSCN溶液,溶液颜色无明显变化,再向试管中通入空气,Fe2+被氧气氧化成Fe3+,与SCN-结合成血红色Fe(SCN)3;
答案为:溶液由浅绿色逐渐变为血红色;
(2)①仪器B的名称球形干燥管;
答案为:球形干燥管;
②实验时,为避免亚铁被氧化,应先通入氮气,冷却时注意关闭开关,冷却至室温再称量固体质量的变化,所缺的实验操作步骤d的操作为待固体冷却至室温,停止通N2;
答案为:待固体冷却至室温,停止通N2;
③重复②的操作步骤,直至A恒重,记为m3g,应为FeSO4和装置的质量,则m(FeSO4)=(m3m1),m(H2O)=(m2m3),则n(H2O)=![]() ,n(FeSO4)=
,n(FeSO4)= ![]() ,结晶水的数目x=
,结晶水的数目x=![]()
![]() ;
;
答案为:![]() ;
;
实验时,为避免亚铁被氧化,应先通入氮气,若实验时按a、d次序操作,会导致硫酸亚铁被氧化,则固体质量偏大,测定结果偏小;
答案为:偏小;
(3)①按信息:分解得到的气体产物之一——SO3,实验后反应管中残留固体为红色粉末,说明生成Fe2O3,则反应中Fe元素化合价升高,S元素化合价应降低,则一定生成SO2,可知硫酸亚铁高温分解可生成Fe2O3、SO3、SO2,C为氯化钡,用于检验SO3,可观察到产生白色沉淀,D为品红,可用于检验SO2,品红褪色,据此选择C、D中的溶液;
答案为:c;a;
C中氯化钡吸收了SO3产生白色沉淀、SO2不与氯化钡反应,逸出后与品红反应使之褪色;
答案为:有白色沉淀产生; 品红溶液褪色;
②据以上分析可写出硫酸亚铁高温分解反应的化学方程式为: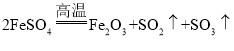 。
。
③尾气SO2有毒,需要用氢氧化钠溶液来吸收,同时要防倒吸,因此在方框中画出尾气吸收装置并注明所用试剂为: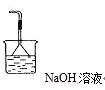 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】钛及其化合物在化工、医药、材料等领域有着广泛的应用。
(1)基态钛原子的价电子排布式为_____________,与钛同周期的元素中,基态原子的未成对电子数与钛相同的有____________种。
(2)钛比钢轻、比铝硬,是一种新兴的结构材料,钛的硬度比铝大的原因是_________。
(3)在浓的TiCl3的盐酸溶液中加入乙醚,并通入HCl至饱和,可得到配位数为6、组成为TiCl3·6H2O的绿色晶体,该晶体中两种配体的物质的量之比为1:5,则该配合离子的化学式为___________。
(4)半夹心结构催化剂M能催化乙烯、丙烯、苯乙烯的聚合,其结构如下图所示。
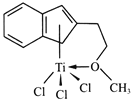
①组成M的元素中,电负性最大的是_________(填名称)。
②M中碳原子的杂化方式为____________。
③M中不含________(填代号)。
a.π键 b.σ键 c.离子键 d.配位键
(5)金红石(TiO2)是含钛的主要矿物之一。其晶胞结构(晶胞中相同位置的原子相同)如图所示。
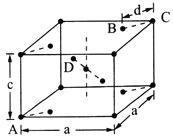
①A、B、C、D 4种微粒,其中氧原子是________(填代号)。
②若A、B、C的原子坐标分别为A(0,0,0)、B(0.69a,0.69a,c)、C(a,a,c),则D的原子坐标为D(0.19a,____,___);钛氧键的键长d=______(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关能量的判断和表示方法正确的是
A.由C(s,石墨)=C(s,金刚石) H=+1.9 kJ/mol,可知:石墨比金刚石更稳定
B.等质量的硫蒸气和硫固体分别完全燃烧,后者放出的热量更多
C.由H+(aq)+OH-(aq) =H2O(l) H=-57.3 kJ/mol,可知:含1 mol CH3COOH的溶液与含1 mol NaOH的溶液混合,放出热量等于57.3 kJ
D.2 g H2完全燃烧生成液态水放出285.8 kJ热量,则氢气燃烧的热化学方程式为2H2(g)+O2(g) =2H2O(l) H=-285.8 kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,Fe与水并不发生反应,但在高温下,Fe与水蒸气可发生反应。高温下Fe与水蒸气的反应实验应使用如图所示的装置,在硬质玻璃管中放入铁粉和石棉绒的混合物,通入水蒸气并加热。请回答实验的相关问题。
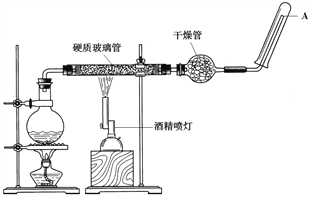
(1)该反应的反应方程式为_________。
(2)圆底烧瓶中装的是水,该装置的主要作用是______________;烧瓶底部放了几片碎瓷片,碎瓷片的作用是________________________。
(3)干燥管中盛装的物质是____________,作用是________________________。
(4)如果要在A处玻璃管口点燃该气体,则必须对该气体进行____________,方法是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳和硅均为元素周期表中第IV A族的元素,其单质和化合物有着重要应用。
(1)石墨烯是只有一个碳原子直径厚度的单层石墨,最早是由科学家用机械剥离的方法从石墨中分离出来,其部分性能优于传统的硅材料,具有广泛的应用前景。
①写出基态碳原子的电子排布式________。石墨烯中C的杂化类型为________。
②下图为单层石墨烯的结构示意图。12 g的石墨烯中由C原子连接成的六元环的物质的量约为________mol。

③石墨烯加氢制得的石墨烷,可用![]() 表示。下列有关叙述正确的是________。
表示。下列有关叙述正确的是________。
a.石墨烷属于烷烃 b.石墨烷难溶于水
c.石墨烷中所有碳原子共平面 d.石墨烷可以发生加成反应
④石墨烯可由加热![]() 晶体脱除
晶体脱除![]() 的方法制得。该过程属于________。
的方法制得。该过程属于________。
a.物理变化 b.分解反应 c.氧化还原反应
(2)![]() 的晶体结构与晶体硅类似。
的晶体结构与晶体硅类似。![]() 的晶体类型为________,晶体中
的晶体类型为________,晶体中![]() 原子与
原子与![]() 键的数目之比为________。
键的数目之比为________。
(3)![]() 与
与![]() 空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:__________________________。
空间构型相似,但性质不同:前者不易与水反应,但后者与水剧烈反应,生成两种酸和一种气体,写出该反应的化学方程式:__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】诺贝尔奖获得者屠呦呦带领团队发现了青蒿素,为中医药科技创新和人类健康事业作出巨大贡献。我国化学家在确认青蒿素分子结构之后实现了青蒿素的全合成。根据信息(部分条件和步骤已省略)回答下列问题:
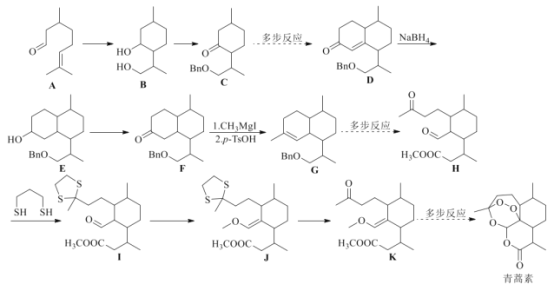
已知:![]() ,按要求回答下列问题:
,按要求回答下列问题:
(1)B的分子式为________________,所含官能团名称为________________________。![]() 的反应类型为________________。
的反应类型为________________。
(2)A的同系物中含碳原子数目最少的物质的结构简式为________________。A的同分异构体X含有醛基和六元碳环,且环上只有一个支链,满足上述条件的X有________种,其中核磁共振氢谱峰数最少的物质的结构简式为________________。
(3)写出A与银氨溶液反应的化学方程式________________________________。
(4)通过![]() 的反应,分子中引入了硫醚基团,而
的反应,分子中引入了硫醚基团,而![]()
![]() 的反应,分子中硫醚基团又被脱去,这样做的目的是________________。
的反应,分子中硫醚基团又被脱去,这样做的目的是________________。
(5)根据青蒿素所含官能团,推测其可能具有的性质________。
a.具有氧化性 b.可发生水解反应 c.易溶于水
(6)参照上述合成路线,写出以![]() 为主要原料,经四步反应制备
为主要原料,经四步反应制备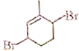 的流程。_____________
的流程。_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知在1×105 Pa、298 K条件下,2 mol氢气燃烧生成水蒸气放出484 kJ热量,下列热化学方程式正确的是( )
A.H2O(g)= H2(g)+![]() O2(g) ΔH=242 kJ·mol-1
O2(g) ΔH=242 kJ·mol-1
B.2H2(g)+O2(g)= 2H2O(l) ΔH=-484 kJ·mol-1
C.H2(g)+![]() O2(g)= H2O(g) ΔH=242 kJ·mol-1
O2(g)= H2O(g) ΔH=242 kJ·mol-1
D.2H2(g)+O2(g)= 2H2O(g) ΔH=484 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫在自然界中以游离态和多种化合态形式出现,硫的化合物大多具有氧化性或还原性,许多金属硫化物难溶于水。完成下列填空:
(1)SO2能使KMnO4溶液褪色,还原产物是MnSO4,写出该反应的化学方程式__________。
(2)将SO2通入BaCl2溶液至饱和,未见沉淀生成,滴加溴水后,出现白色沉淀,该白色沉淀化学式为________。
(3)向Na2S固体中分别加入浓硫酸和稀硫酸,所得产物__________(填“相同”或“不同”),由此可知硫酸氧化性的强弱与__________有关。
(4)已知NaHSO3溶液显酸性,溶液中离子浓度由大到小的顺序是_____________。
(5)为了使Na2S溶液中c(Na+)/c(S2)的比值变小,可适量加入(或通入)的物质是___________
a.H2S气体 b.NaOH固体 c.HCl气体 d.KOH固体
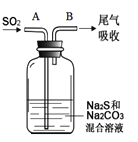
(6)在图中,从A管通入一定量SO2后,在B处检测到有新的气体生成。B处排出的气体中(填“含”或“不含”)___________H2S。(已知:酸性H2SO4>H2CO3≈H2S)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)关注营养平衡,促进身心健康。从下列四种物质中选择相应字母代号回答下列问题:
A 靑霉素 B 水 C 酱油 D 纤维素
①为最重要的抗生素,属于消炎药的是____;
②能刺激肠道蠕动,有助于食物消化的是___;
③为促进铁的吸收,我国选择作为铁强化食物的载体是___;
④属于人体的重要组成成分,每人每天要补充2.5~4.0L的是___。
(2)探索材料,丰富生活。请回答下列问题:
①家用菜刀的主要材质是用____;
A 铁合金 B 铝合金
②汽车轮胎的主要成分是___;
A 合成纤维 B 合成橡胶
③传统硅酸盐产品主要指____、陶瓷和水泥。
(3)保护生存环境,我们都在行动。请回答下列问题:
①正常雨水偏酸性,pH约为___;
②利用沉淀反应是除去水中重金属离子的常用方法。例如,向含Hg2+的废水中加入Na2S,可以使Hg2+转化为沉淀而除去。该反应的离子方程式为_____;
③我国《城市生活垃圾分类标志》中,代表回收标志的是_____;
A  B
B 
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com