
| A. |  闻气体气味 | B. | 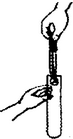 取用块状固体 | ||
| C. | 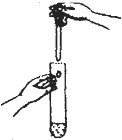 滴加液体 | D. | 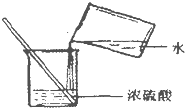 稀释浓硫酸 |
分析 A.闻气体的气味时,不能直接用鼻子闻,一些气体有毒或刺激性;
B.取用块状固体时,不能直接如图放入,将会砸裂试管底部;
C.使用胶头滴管滴加少量液体的操作,注意胶头滴管的位置是否伸入到试管内或接触试管;
D.稀释浓硫酸时,沿烧杯内壁将浓硫酸缓缓加入水中,边加边搅拌.
解答 解:A.闻气体的气味时,为了防止气体有毒,应用手扇动,不能直接用鼻子闻,故A错误;
B.取用块状固体时,先将试管横放,用镊子把固体放在试管口,再让试管慢慢地竖起来,故B错误;
C.使用胶头滴管滴加少量液体的操作,注意胶头滴管的位置是否伸入到试管内或接触试管内壁.应垂直悬空在试管口正上方滴加液体,防止污染胶头滴管,故C正确;
D.稀释浓硫酸时,图中水注入到硫酸里面操作错误,应沿烧杯内壁将浓硫酸缓缓加入水中,否则会溅出伤人,故D错误.
故选C.
点评 本题考查化学实验方案的评价,为高频考点,涉及固体药品的取用、闻气体的气味的方法,胶头滴管的使用,稀释浓硫酸的方法等,侧重实验基本操作和实验原理的考查,注意装置的作用及实验的操作性、评价性分析,题目难度不大.


科目:高中化学 来源: 题型:解答题

 ;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;在电解过程中阳极(填“阴”或“阳”)需要定期补充.
;工业上,用冰晶石作助熔剂、石墨作电极电解熔融氧化铝制铝,请写出电解反应方程式2Al2O3$\frac{\underline{\;电解\;}}{\;}$4Al+3O2↑;在电解过程中阳极(填“阴”或“阳”)需要定期补充.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向豆浆中加入盐卤做豆腐 | |
| B. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| C. | 高压除尘 | |
| D. | 黄河入海口处容易形成三角洲 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为常见的气体,通入澄清石灰水中,石灰水变浑浊.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E元素在地壳中含量位居第四位,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E.其中A、B、C是同一周期的非金属元素.化合物DC为离子化合物,D的二价阳离子与C的阴离子具有相同的电子层结构.AC2为常见的气体,通入澄清石灰水中,石灰水变浑浊.B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高.E元素在地壳中含量位居第四位,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于外界.请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | a=10、b=9.2 | B. | a<10、b>9.2 | C. | a>10、b=9.2 | D. | a>10、b<9.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2
现有如下两个反应:(A)NaOH+HCl═NaCl+H2O (B)2FeCl3+Fe═3FeCl2查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,23g NO2和N2O4的混合气体中含有NA个氧原子 | |
| B. | 常温下,pH=1的H2SO4溶液中含有的H+的数目为0.1NA | |
| C. | 标准状况下,2.24L SO3中含有硫原子的数目为NA | |
| D. | 标准状况下,22.4L Cl2完全溶于水时,转移电子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下pH=7的溶液中:Fe3+,Mg2+,SO42-,Cl-能大量共存 | |
| B. | 常温下水电离出c(H+)×c(OH-)=10-10的溶液中:Na+,NH4+,CH3COO-,F-不能大量共存 | |
| C. | 在含有HCO3-,HSO3-,CH3COO-,S2-四种阴离子的溶液中加入足够的Na2O2固体后,S2-浓度变化最小 | |
| D. | SO2,O2,HCl,CO2四种气体,可以大量共存于同一容器中 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com