
����Ŀ��Ԫ�����ڱ��е�������Ԫ��������3d���ӵ�Ӱ�죬���ʵĵݱ�����������Ԫ�����в�ͬ��
��1����������Ԫ�صĵ�һ��������ԭ��������������������������ģ� �أ�31Ga���Ļ�̬�����Ų�ʽ����
31Ga�ĵ�һ������ȴ���Ե���30Zn��ԭ������
�������ڹ���Ԫ�ص������������γɶ��ֶ���������
CO��NH3���Ժͺܶ���ɽ����γ�����CO��N2��Ϊ�ȵ����壬CO������Cԭ������һ�µ��Ӷԣ�C��Oԭ�Ӷ�����8�����ȶ��ṹ����CO�Ľṹʽ�ɱ�ʾΪ �� NH3������Nԭ�ӵ��ӻ���ʽΪ�ӻ���NH3���ӵĿռ����幹���� ��
��2����ʢ������ͭˮ��Һ���Թ��мӰ�ˮ�������γ���ɫ�������������백ˮ�����ܽ⣬�õ�����ɫ����Һ�������Һ�м��Ҵ�����������ɫ���壮��ɫ�������ܽ⣬��������ԭ���ǣ�������ص����ӷ���ʽ�ͼ�����˵�����Խ��ͣ���
��3����ͼ����ʾΪ��άƽ�澧��ʾ��ͼ������ʾ�Ļ�ѧʽΪAX3���� �� 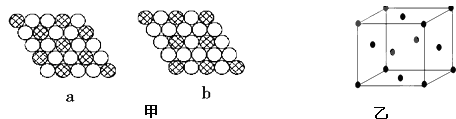
��4��ͼ��Ϊһ������ͭ�ľ������˾���������ı߳�Ϊa cm��Cu�����ԭ������Ϊ64������ͭ���ܶ�Ϊ�� g/cm3 �� ���ӵ������ɱ�ʾΪmol��1���ú�a���ѵĴ���ʽ��ʾ����
���𰸡�
��1��1s22s22p63s23p63d104s24p1��Znԭ�ӵļ۵����Ų�ʽΪ3d104s2 �� 4s���Ϊȫ����״̬����ϵ�������ϵͣ����ȶ�����Zn�ĵ�һ�����ܴ���Ga��![]() ��sp3��������
��sp3��������
��2��������ͭ�백ˮ������Ӧ��Cu��OH��2+4NH3?H2O=[Cu��NH3��4]2++2OH��+4H2O�������Һ�м��Ҵ������ɵ�[Cu��NH3��4]SO4�ڼ��Լ��Ե��Ҵ����ܽ�ȼ�С�������õ�����ɫ�ľ���
��3��b
��4��![]()
���������⣺������31��Ԫ�أ���ԭ�Ӻ�����31�����ӣ�4S�ܼ�����С��3d�ܼ������������������ԭ������������4s�ܼ�����3d�ܼ����������������Ų�ʽΪ1s22s22p63s23p63d104s24p1�� Znԭ�ӵļ۵����Ų�ʽΪ3d104s2 �� 4s���Ϊȫ����״̬�����ȶ�����Zn�ĵ�һ�����ܴ���Ga��
���Դ��ǣ�1s22s22p63s23p63d104s24p1��Znԭ�ӵļ۵����Ų�ʽΪ3d104s2 �� 4s���Ϊȫ����״̬����ϵ�������ϵͣ����ȶ�����Zn�ĵ�һ�����ܴ���Ga��
��1��C��Oԭ�Ӷ�����8�����ȶ��ṹ��Cԭ������ԭ��֮�����2����ͨ���ۼ���1����λ����Cԭ������ԭ��֮���γ��������ṹʽΪ ![]() ��
��
NH3������Nԭ�ӳ�3��N��H��������1�Թµ��Ӷԣ�Nԭ���ӻ���ʽΪsp3 �� �ռ�ṹΪ�����Σ�
���Դ��ǣ� ![]() ��sp3�������Σ���2��������ͭ�백ˮ������Ӧ��Cu��OH��2+4NH3H2O=[Cu��NH3��4]2++2OH��+4H2O�������ܽ⣬�����Һ�м��Ҵ������ɵ�[Cu��NH3��4]SO4�ڼ��Լ��Ե��Ҵ����ܽ�ȼ�С�������õ�����ɫ�ľ��壬
��sp3�������Σ���2��������ͭ�백ˮ������Ӧ��Cu��OH��2+4NH3H2O=[Cu��NH3��4]2++2OH��+4H2O�������ܽ⣬�����Һ�м��Ҵ������ɵ�[Cu��NH3��4]SO4�ڼ��Լ��Ե��Ҵ����ܽ�ȼ�С�������õ�����ɫ�ľ��壬
���Դ��ǣ�������ͭ�백ˮ������Ӧ��Cu��OH��2+4NH3H2O=[Cu��NH3��4]2++2OH��+4H2O�������Һ�м��Ҵ������ɵ�[Cu��NH3��4]SO4�ڼ��Լ��Ե��Ҵ����ܽ�ȼ�С�������õ�����ɫ�ľ��壻��3��aͼ��ÿ��б������Χ��6����ɫ��ÿ����ɫ��Ϊ3��б�����У���б�������ɫ����Ŀ֮��=
1��6�� ![]() =1��2��
=1��2��
bͼ��ÿ��б������Χ��6����ɫ��ÿ����ɫ��Ϊ2��б�����У���б�������ɫ����Ŀ֮��=1��6�� ![]() =1��3��
=1��3��
��ͼb���ϻ�ѧʽΪAX3 ��
���Դ��ǣ�b����4�������к���ͭԭ����Ŀ=8�� ![]() +6��
+6�� ![]() =4��������Ϊ
=4��������Ϊ ![]() g���þ������Ϊa3 cm3 �� ��
g���þ������Ϊa3 cm3 �� �� ![]() g=a3 cm3���� g/cm3 �� ��NA=
g=a3 cm3���� g/cm3 �� ��NA= ![]() ��
��
���Դ��ǣ� ![]() ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼΪij��ѧ��Ӧ��������ʱ��Ĺ�ϵʾ��ͼ����t1ʱ�������¶Ȼ�����ѹǿ�����ʵı仯������ʾ��ͼ�ķ�Ӧ�ǣ� ��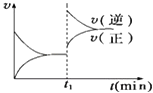
A.2SO2��g��+O2��g��2SO3��g����H��0
B.4NH3��g��+5O2��g��4NO��g��+6H2O��g����H��0
C.H2��g��+I2��g��2HI��g����H��0
D.2A��g��+B��g��2C��g����H��0
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪298Kʱ������Ӧ���й����ݣ�C��s��+ ![]() O2��g��=CO��g����H1=��110.5kJmol��1 C��s��+O2 ��g��=CO2��g������H 2=��393.5kJ/mol ��C��s��+CO2��g��=2CO��g�� �ġ�HΪ�� ��
O2��g��=CO��g����H1=��110.5kJmol��1 C��s��+O2 ��g��=CO2��g������H 2=��393.5kJ/mol ��C��s��+CO2��g��=2CO��g�� �ġ�HΪ�� ��
A.283��kJmol��1
B.172.5 kJmol��1
C.��172.5 kJmol��1
D.��504 kJmol��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ���������;���ж�Ӧ��ϵ����
A.Al(OH)3���������ԣ�����������θ�����
B.Ũ���������ˮ�ԣ������ڸ�������
C.SiO2����̼��Ӧ���������Ʊ����ά
D.�������ױ���������������ȡ��ȩ��֬
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��50mL 0.50mol/L�����50mL 0.55mol/L NaOH��Һ����ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ���������ų��������ɼ��㷴Ӧ�ȣ� 
��1���ձ���������ĭ���ϵ���������
��2����ͼ��ʾ������A������������ʵ������У���������¶ȼ��ϵ�����ˮ��ϴ�ɾ�ֱ�Ӳ���NaOH��Һ���¶ȣ����õġ�H��57.3KJ/mol�����������������=������
��3��������ϡǿ�ᡢϡǿ�Ӧ����1molˮʱ�ų�57.3kJ��������д��ϡ�����ϡ����������Һ��Ӧ���к��ȵ��Ȼ�ѧ��ʽ��
��4������ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к��ȵ���ֵ�������ƫ����ƫС��������Ӱ�족��
��5��Ϊ�˲���ij��Ӧ���к��ȣ�����ʱ������Ҫ��������
�����Ũ�Ⱥ���� �ڼ��Ũ�Ⱥ���� �۱����� �ܷ�Ӧ����Һ������ ������ˮ�����ʵ��� ��Ӧǰ���¶ȱ仯�߲��������ʱ��
A.�٢ڢۢ�
B.�٢ۢܢ�
C.�ۢܢݢ�
D.ȫ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧ�У����������������ڷ�Ӧ������������
A. þ����ϡ���ᷴӦB. ����ȼ��
C. ̼������ȷֽ�D. �кͷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
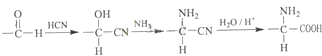
����Ŀ���л���ѧ������G��һ�ֳ����İ����ᣬ��ϳ�·������ 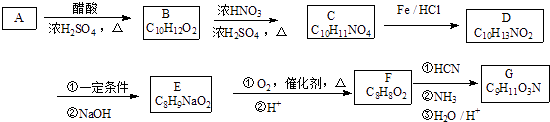
��֪������Ϣ��
��A������ֻ��1��ȡ�����Һ˴Ź���������6��壬�������Ϊ1��2��2��2��2��1��D��F�ı����ϵ�һ�ȴ��ﶼֻ��2�֣�
��F��G����FeCl3��Һ������ɫ��Ӧ��F�ܷ���������Ӧ
�� 
�ش���������
��1��A�ķ���ʽΪ��������Ϊ ��
��2��A��B�ķ�Ӧ������������A��B���õ��Լ��� ��
��3��B��C�Ļ�ѧ����ʽΪ ��
��4��G�Ľṹ��ʽΪ ��
��5��F��ͬ���칹���壬���б������ܷ���ˮ�ⷴӦ���칹�����֣����к˴Ź���������4��壬�������Ϊ3��2��2��1���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���뽫���з�Ӧ��˫����д��
��1��8H++2NO3��+3Cu=Cu 2++2NO��+4H2O
��2��KClO3+6HCl=KCl+3Cl2��+3H2O��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. 2 mol�Ĵ��� B. 0.3 mol HCl C. 0.1 mol�� D. 4 mol����Ԫ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com