
下列指定粒子的个数比为1∶2的是( )
A.Be2+中的质子和电子
B. 中的质子和中子
中的质子和中子
C.NaHCO3中的阳离子和阴离子
D.Na2O2中的阴离子和阳离子
 黄冈小状元同步计算天天练系列答案
黄冈小状元同步计算天天练系列答案科目:高中化学 来源:2014年高一化学人教版必修二 2-2-2发展中的化学电源练习卷(解析版) 题型:填空题
化学电池在通讯、交通及日常生活中有着广泛的应用。
(1)目前常用的镍镉(Ni—Cd)电池,其电池总反应可以表示为:
Cd+2NiO(OH)+2H2O 2Ni(OH)2+Cd(OH)2
2Ni(OH)2+Cd(OH)2
已知Ni(OH)2和Cd(OH)2均难溶于水但能溶于酸,以下说法正确的是________(填字母序号)。
①以上反应是可逆反应 ②以上反应不是可逆反应 ③充电时化学能转变为电能 ④放电时化学能转变为电能
A.①③ B.②④
C.①④ D.②③
(2)废弃的镍镉电池已成为重要的环境污染物,有资料表明,一节废镍镉电池可以使1 m2面积的耕地失去使用价值。在酸性土壤中这种污染尤为严重,这是因为______________________。
(3)另一种常用的电池锂电池(锂是一种碱金属元素,其相对原子质量为7),由于它的比容量(单位质量电极材料所能转换的电能)特别大而广泛应用于心脏起搏器,一般使用时间可长达十年,它的负极由金属锂制成,电池总反应可表示为Li+MnO2=LiMnO2。
试回答:锂电池比容量特别大的原因是___________________________。
锂电池中的电解质溶液需用非水溶液配制,为什么这种电池不能使用电解质的水溶液?请用化学方程式表示其原因:___________________________________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 2-1化学能与热能练习卷(解析版) 题型:选择题
下列说法正确的是( )
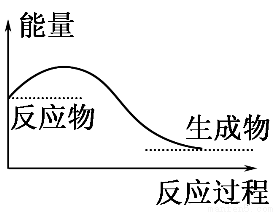
A.任何化学反应都伴随着能量的变化
B.H2O(g)―→H2O(l)的过程放出大量的热,所以该过程是化学变化
C.化学反应中能量的变化都表现为热量的变化
D.如图所示的是吸收能量的过程
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 1-3-2共价键练习卷(解析版) 题型:选择题
下列分子中所有原子都满足最外层为8电子结构的是( )
A.CCl4 B.NO2 C.PCl5 D.NH3
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 1-3-1离子键练习卷(解析版) 题型:实验题
请根据教材上的实验“钠与氯气反应”,完成下列问题。
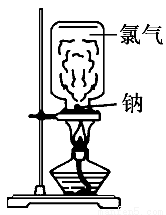
(1)取一块绿豆大的金属钠(切去氧化层),用滤纸吸净其表面的煤油,放在石棉网上,用酒精灯微热。待钠熔成球状时,将盛有氯气的集气瓶迅速倒扣在钠的上方。根据所学的知识分析该实验存在哪些缺点?
①____________________________________________________;
②____________________________________________________;
③________________。(至少填2条)
(2)某同学根据以上存在的缺点改进实验装置,如图所示:

实验步骤:
a.取绿豆粒大的钠,用滤纸吸干表面的煤油,切去氧化层,放入玻璃管中,按图示安装好仪器;
b.慢慢滴加浓盐酸,立即剧烈反应产生氯气;
c.当玻璃管中充满黄绿色气体时,再加热钠,钠熔化并燃烧。
①观察到的实验现象有:当滴加浓盐酸后试管中产生________色气体;钠剧烈燃烧,火焰呈________色且有________生成,反应结束后,管壁上观察到有________生成。
②改进后的实验优点:a.________,b.________,c.______(至少回答2条)。
③写出Na在Cl2中燃烧的化学方程式________________,并用电子式表示产物形成过程________________。
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 1-3-1离子键练习卷(解析版) 题型:选择题
下列说法中正确的是( )
A.难失电子的原子,获得电子的能力一定强
B.易得电子的原子所形成的简单阴离子,其还原性一定强
C.活泼金属与活泼非金属化合,易形成离子键
D.电子层结构相同的不同离子,核电荷数越多,半径越小
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 1-2-2元素周期律练习卷(解析版) 题型:填空题
元素周期表是学习化学的重要工具,它隐含许多信息和规律。下表所列是五种短周期的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号ABCDE
原子半径/nm0.160.1430.1020.0990.074
主要化合价+2+3+6,-2-1-2
(1)用元素代号标出它们在元素周期表中对应的位置(以下为周期表的一部分)。
(2)B元素处于周期表中第__________周期、第________族。
(3)B的最高价氧化物对应的水化物与C的最高价氧化物对应的水化物反应的离子方程式为______________。
(4)上述五种元素的最高价氧化物对应水化物酸性最强的是________(填化学式)。
(5)C、E形成的化合物为________(填化学式)。
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 1-2-1原子核外电子排布练习卷(解析版) 题型:选择题
已知某粒子的结构示意图为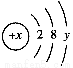 。
。
试回答:
(1)当x-y=10时,该粒子为________(填“原子”“阳离子”或“阴离子”)。
(2)当y=8时,粒子可能为(填粒子符号)______、______、______、______、________。
(3)写出y=3与y=7的元素最高价氧化物对应水化物间发生反应的离子方程式:_________________________________________ _______________________________。
查看答案和解析>>
科目:高中化学 来源:2014年高一化学人教版必修二 1-1-2元素性质练习卷(解析版) 题型:选择题
下列说法正确的是( )
A.F、Cl、Br的最外层电子数都是7,次外层电子数都是8
B.从HF、HCl、HBr、HI酸性递增的事实,推出F、Cl、Br、I的非金属性递增规律
C.卤素按F、Cl、Br、I的顺序其非金属性逐渐减弱的原因是随着核电荷数增加电子层数增大起主要作用
D.砹是原子序数最大的卤族元素,根据卤素性质的递变规律,砹易溶于水,难溶于CCl4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com