
����˵����ȷ���ǣ��� ��
��˫��ˮ�����궼�ǻ����
����Ȼ����ˮú�����ǿ�������Դ �۹��ۻ�����һ������ǿ�����
��1moINa2O2������H2O��Ӧ��ת�Ƶ�����Ϊ2NA
�ݻ�ѧ����Ҫ�ص���ԭ�ӡ�����ˮƽ����ʶ���ʣ���ѧ����ʶ�𡢸ı�ʹ������
��Ԫ�ص���������Ԫ�����ԭ�������ĵ��������������Ա仯
���������о�ˮ���ܣ��ɳ�ȥ���Է�ˮ�����Է�ˮ�е���������
�� ����������������������������ԭ��һ���Ƿǽ���Ԫ�ص�ԭ��
��L�����Ϊż������������Ԫ����������������Ԫ��ԭ�ӵ�L����������
A �٢ݢޢ� B �ڢݢ� C�٢ݢ� D �ڢݢߢ��
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
2.8g Feȫ������һ��Ũ��200mL��HNO3��Һ�У��õ���״���µ�����1.12L����÷�Ӧ����Һ��c(H+ )��0.1mol·L-1 ������Ӧǰ����Һ����仯���Բ��ƣ��������й��ж���ȷ����
A����Ӧ����Һ�д���Fe3+��Fe2+ B��1.12L������NO��NO2�Ļ������
C����Ӧ����Һ��c(NO3��)��0.85mol·L-1 D����Ӧ�����Һ�����ܽ�1.4gFe
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��״�����Т� 6.72 L CH4���� 3.01��1023��HCl���� 13.6g H2S���� 0.2mol NH3�����ж���������Ĺ�ϵ��С�����ʾ����ȷ����
A��������ܣ��٣��ڣ��� B���ܶȣ��٣��ܣ��ۣ���
C���������ܣ��٣��ۣ��� D����ԭ�������ڣ��ܣ��ۣ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��״���£�ʹNO2��O2��4��1������ȳ���������ƿ������ƿ������ˮ�У�ƿ��Һ����������������ƿ����Һ����ɢ�������ո���Һ�����ʵ����ʵ���Ũ��Ϊ
A. mol��L��1 B.
mol��L��1 B. mol��L��1 C.
mol��L��1 C. mol��L��1 D.
mol��L��1 D. mol��L��1
mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
X��Y��Z��R ��W��5�ֶ�����Ԫ�أ�ԭ�����������������ǿ�������ӻ�����Z2Y���ۻ�����RY3��XW4����֪Y��Rͬ���壬 Z��R ��Wͬ���ڡ�����˵��������ǣ� ��
A����̬�⻯���ȶ��ԣ�HmW>HnR
B����״���£�1mol XW4�����ԼΪ22.4L
C��Y��Z�γɵ�ij�ֻ������к����Ӽ����Ǽ��Խ�
D��Y��Z��R�����γɵ�ij�ֻ���������ˮ���γɼ�����Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�������и�װ��ͼ����������ȷ����
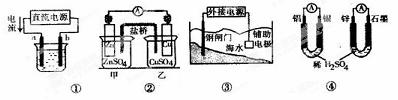
A����ͼ��װ�þ���ͭ��a��Ϊ��ͭ��bΪ��ͭ���������ҺΪCuSO4��Һ
B��ͼ��װ�õ�������KCl��Cl-�������ձ�
C��ͼ��װ���и�բ��Ӧ����ӵ�Դ�ĸ���������ñ���
D��ͼ������װ����ͨ�����ߵĵ�������ͬʱ�����ĸ������ϵ����ʵ�����ͬ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
������Ϊ37��ԭ��Ӧ���� �� ��
A.18�����ӣ�19�����ӣ�19������B.17�����ӣ�20�����ӣ�18������
C.19�����ӣ�18�����ӣ�20������D.18�����ӣ�19�����ӣ�18������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
�����йؼ�����(Rb)�������У�����ȷ���� �� ��
A�������Ȼ��ʱ��������������ɫ B������������ӻ����������ˮ
C�����ơ��ء�����ֵ����У�卑��۵���� D�����������ǿ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
H2O2����Ҫ��������������ˮ��Һ������������ɱ����Ư�ȡ���ش������й����⡣
 ��1��2H2O2��l��===2H2O��l��+O2��g����Ӧ�����е� �����仯��ͼ��ʾ����֪1 mol H2O2��l���ֽ�ʱ�ġ�H= ��98.23 kJ��mol-1
��1��2H2O2��l��===2H2O��l��+O2��g����Ӧ�����е� �����仯��ͼ��ʾ����֪1 mol H2O2��l���ֽ�ʱ�ġ�H= ��98.23 kJ��mol-1
��H2O2�ķֽⷴӦ���������Է����У���ԭ����
���÷�Ӧ����MnO2�������������MnO2��ʹͼ��B�� ������ߡ��������͡�����ͼ��
��H= ��
��2��ij��ѧ��ȤС��������KMnO4����Һ�ζ�H2O2��Һ��Ʒ���ⶨH2O2��Һ��H2O2 �ĺ�����
�䷴Ӧ�����ӷ���ʽΪ��5H2O2+2MnO4��+6H+=2Mn2++5O2��+8H2O
������KMnO4��ҺӦ���� �����ʽ����ʽ�����ζ����С�
����KMnO4��Һ�ζ�H2O2��Ʒ���յ�ʱ��Һ��ɫ�仯Ϊ ��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com