
【题目】某学生用NaHCO3和KHCO3组成的混合物样品与某种浓度的盐酸反应进行实验,测得数据如下表:
实验编号 | ① | ② | ③ |
盐酸体积/L | 50 | 50 | 50 |
m(混合物)/g | 9.2 | 26.56 | 36.8 |
V(CO2)(标准状况)/L | 2.24 | 4.48 | 4.48 |
分析表中数据,下列说法中不正确的是( )
A. 由①②可知:①中的盐酸过量
B. 由②③可知:混合物的质量增加,而气体体积没有变化,说明盐酸已经完全反应
C. 所用盐酸的物质的量浓度为0.4 mol·L-1
D. 该混合物中NaHCO3的物质的量分数为50%
【答案】C
【解析】A. ②混合物的质量增加,生成二氧化碳,所以①中的盐酸过量,故A正确;B. 由②③可知:混合物的质量增加,而气体体积没有变化,说明盐酸已经完全反应,故B正确;C. 50mL盐酸完全反应生成4.48L即0.2mol二氧化碳,![]() + H+=H2O+CO2↑,氯化氢的物质的量等于二氧化碳的物质的量为0.2mol,所以所用盐酸的物质的量浓度为0.2mol/0.05L=4mol·L-1,故C不正确;D. 9.2g混合物完全反应生成2.24L即0.1mol二氧化碳,可以得出NaHCO3和KHCO3的物质的量相等,所以该混合物中NaHCO3的物质的量分数为50%,故D正确。故选C。
+ H+=H2O+CO2↑,氯化氢的物质的量等于二氧化碳的物质的量为0.2mol,所以所用盐酸的物质的量浓度为0.2mol/0.05L=4mol·L-1,故C不正确;D. 9.2g混合物完全反应生成2.24L即0.1mol二氧化碳,可以得出NaHCO3和KHCO3的物质的量相等,所以该混合物中NaHCO3的物质的量分数为50%,故D正确。故选C。


科目:高中化学 来源: 题型:
【题目】关于下图所示的原电池,下列说法正确的是( )

A. 电子从锌电极通过电流表流向铜电极 B. 盐桥中的阴离子向CuSO4溶液中迁移
C. 锌电极发生还原反应,铜电极发生氧化反应 D. 铜电极上发生的电极反应是2H++2e-=H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】汽车的启动电源常用铅蓄电池,该电池在放电时的反应如下:Pb (s)+ PbO2(s) +2H2SO4(aq)![]() 2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是
2PbSO4(s) +2H2O(l),根据此反应判断下列叙述中正确的是
A. PbO2是电池的负极 B. 铅蓄电池属于一次电池
C. 负极的电极反应式为:Pb(s)+SO42-(aq)–2e – = PbSO4(s) D. 电池放电时,溶液酸性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学关系着我们的生活,我们的未来。下列说法正确的是
A. 石墨烯(由碳原子构成的六角形蜂巢晶格)材料属于一种新型化合物
B. 可从海水中提取氯化镁,使氯化镁分解获得镁并释放能量
C. 推广用原电池原理制成的太阳能电池汽车,可减少化石能源的使用
D. 采煤工业爆破时把干冰和炸药放在一起,既能增强爆炸威力又能预防火灾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.人生病时都可以自己到药店买药吃,不用请医生诊治
B.注射青霉素前,一定要先进行皮肤敏感试验
C.长期大量服用阿司匹林可预防疾病,没有副作用
D.虽然药物能治病,但大部分药物有毒副作用
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某无土栽培用的营养液,要求KCl、K2SO4和NH4Cl三种固体原料的物质的量之比为1:4:8。若配置该营养液,取428 g NH4Cl,则需KCl和K2SO4的质量分别为( )
A. 53.5 g和214 g B. 74.5 g和348 g
C. 74.5 g和696 g D. 149 g和696 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】漂白粉在工业上有着重要的应用,某同学利用下列仪器在实验室进行制备漂白粉的实验。请回答下列问题:
I.氯气的制备
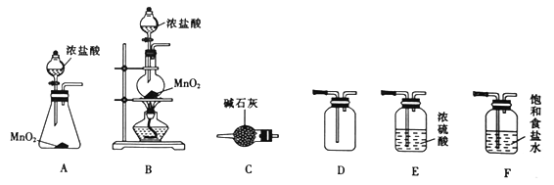
(1)装置C的名称为_______________。
(2)实验室选择上图中的装置制备并收集干燥氯气,其连接顺序为_______________(填字母)。
(3)装置F的作用为___________________________。
Ⅱ.漂白粉的制备
(4)已知:氯气和石灰乳在反应的过程中会放热,当温度较高时会生成Ca(ClO3)2。为了制得纯度较高的漂白粉并提高产率,实验中可采取的措施有__________________、____________________(不改变石灰乳的浓度和体积)。
(5)若将100 mL 12.0 molL-1盐酸与3.48 g MnO2反应制得的氯气全部通入足量的石灰乳中,理论上最多可制得Ca(ClO)2_________g。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知RxO![]() +MnO
+MnO![]() +H+―→RO2+Mn2++H2O变化过程中,0.2 mol RxO
+H+―→RO2+Mn2++H2O变化过程中,0.2 mol RxO![]() 参加反应,共转移0.4 mol 电子。
参加反应,共转移0.4 mol 电子。
(1)反应的氧化产物为________。
(2)x=________。
(3)参加反应的氢离子的物质的量为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com