
 2CO2+N2
2CO2+N2 | 时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
| c(NO) /mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO) / mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:不详 题型:单选题
| A.只有①② | B.只有③④ | C.只有①③④ | D.①②③④ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
 2CO2(g)+N2(g) △H<0。
2CO2(g)+N2(g) △H<0。
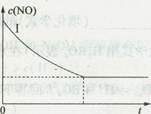
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
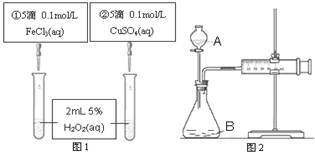
| A.图2中的A为分液漏斗 |
| B.图2实验可通过测定相同状况下产生的气体体积与反应时间来比较反应速率 |
| C.若图1实验中反应速率为①>②,则Fe3+对H2O2分解的催化效果一定比Cu2+好 |
| D.图1实验可通过观察产生气泡的快慢来比较反应速率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| 实验编号 |  T/K T/K | KMnO4浓度 /mol·L-1 | H2C2O4浓度 /mol·L-1 | 实验目的 |
| ① | 298 | 0.01 mol·L-1 | 0.1 mol·L-1 | 为以下实验做对照 |
| ② | | | | |
| ③ | | | | 探究浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
| ①分别取等体积的2 mol/L 硫酸于试管中; ②分别投入大小、  形状相同 形状相同的Cu、Fe、Mg。 | 反应快慢: Mg>Fe>Cu | 反应物的性质越活泼,反应速率越快。 |
 对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持
对化学反应速率的影响;根据控制变量法,要得出正确的实验结论,还需控制的实验条件是保持 条件相同。
条件相同。
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3,如果2 min内SO2的量由12 mol下降为4 mol,则下列说法正确的是
2SO3,如果2 min内SO2的量由12 mol下降为4 mol,则下列说法正确的是 | A.用SO2的浓度变化表示的反应速率为4 mol/(L·min) |
| B.用O2的浓度变化表示的反应速率为2 mol/(L·min) |
| C.增大压强,正反应速率增大,逆反应速率减小 |
| D.升高温度,正反应速率和逆反应速率都增大 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com