
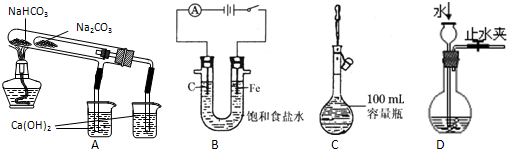


 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:解答题
| 实验 | 主要实验步骤及实验现象 |
| 1 | 向Y溶液中加入稀H2SO4,产生淡黄色沉淀和无色有刺激性气味的气体,该气体能使品红溶液退色. |
| 2 | 向M溶液中连续滴加Z溶液,初有白色沉淀,后沉淀溶解. |
| 3 | 向M稀溶液中滴加硝酸酸化的硝酸银溶液,产生白色沉淀. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
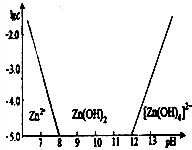
| 沉淀物 | AI(OH)3 | Fe(OH)3 | Fe(OH)2 | Cu(OH)2 | Zn(OH)2 |
| pH | 5.2 | 3.2 | 9.7 | 6.7 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
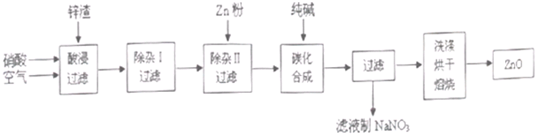
 已知:①HSO3-的还原性比I-强,②IO3-+5I-+6H+=3I2+3H2O.工业上利用NaIO3和NaHSO3反应来制取单质I2.NaIO3来源于自然界的矿物,NaHSO3来源于硫酸工厂尾气处理的产物(用NaOH溶液吸收SO2).
已知:①HSO3-的还原性比I-强,②IO3-+5I-+6H+=3I2+3H2O.工业上利用NaIO3和NaHSO3反应来制取单质I2.NaIO3来源于自然界的矿物,NaHSO3来源于硫酸工厂尾气处理的产物(用NaOH溶液吸收SO2).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图是实验室硫酸试剂标签上的部分内容,据此判断
如图是实验室硫酸试剂标签上的部分内容,据此判断查看答案和解析>>
科目:高中化学 来源: 题型:单选题
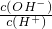 =1012的溶液:K+、Ba2+、Cl-、NO3-
=1012的溶液:K+、Ba2+、Cl-、NO3-查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com