某学校化学兴趣小组设计实验来探究“外界条件对化学反应速率的影响”.
Ⅰ小组A利用H
2C
2O
4溶液和酸性KMnO
4溶液反应实验时,先分别量取两种溶液,然后倒入试管中迅速振荡混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢.方案数据如表所示.
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ |
| 浓度mol?L-1 | 体积mL | 浓度 mol?L-1 | 体积mL |
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
(1)小组A的实验目的是
.
(2)已知反应后H
2C
2O
4转化为CO
2逸出,KMnO
4转化为MnSO
4,每消耗1mol H
2C
2O
4转移
mol电子.为了观察到紫色褪去,H
2C
2O
4与KMnO
4初始的物质的量需要满足的关系为:c(H
2C
2O
4):c(KMnO
4)≥
.
(3)实验①测得KMnO
4溶液的褪色时间为40s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMnO
4)=
mol?L
-1?min
-1.(保留两位有效数字)
Ⅱ小组B利用Na
2S
2O
3溶液与稀硫酸混合反应来探究温度对化学反应速率的影响.
(4)补充完成该反应方程式:H
2SO
4+Na
2S
2O
3═Na
2SO
4+H
2O+SO
2+
(除空缺外已配平).
(5)该小组设计了如表的实验方案(已知各溶液体积均为5mL),请填写表格中划线部分.
| 实验编号 | T/K | c(Na2S2O3)/mol?L-1 | c(H2SO4)/mol?L-1 | 实验目的 |
| ① | 298 | 0.1 | 0.1 | 探究温度对该反应速率的影响
|
| ② | 308 | | |
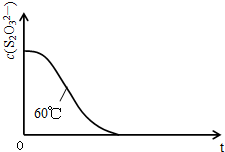
(6)已知60℃时c(S
2O
32-)~反应时间t的变化曲线如图所示.若保持其他条件不变,请在坐标图中,画出45℃时c(S
2O
32-)~t的变化曲线示意图,并作出必要的标注.

 某学校化学兴趣小组设计实验来探究“外界条件对化学反应速率的影响”.
某学校化学兴趣小组设计实验来探究“外界条件对化学反应速率的影响”. ,故答案为:
,故答案为: .
.