
【题目】一水合甘氨酸锌是一种矿物类饲料添加剂,结构简式如图:

(1)基态Zn2+的价电子排布式为__;一水合甘氨酸锌中所涉及的非金属元素电负性由大到小的顺序是__。
(2)甘氨酸(H2N-CH2-COOH)中N的杂化轨道类型为__;甘氨酸易溶于水,试从结构角度解释__。
(3)一水合甘氨酸锌中Zn2+的配位数为__。
(4)[Zn(IMI)4](ClO4)2是Zn2+的另一种配合物,IMI的结构为![]() ,则1molIMI中含有__σ键。
,则1molIMI中含有__σ键。
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物为液态而非固态,原因是__。

(6)Zn与S形成某种化合物的晶胞如图Ⅰ所示。
①Zn2+填入S2-组成的__空隙中(填“四面体”或“八面体”);
②由图不能判断出S2-、Zn2+相切,若要使S2-、Zn2+相切,则Zn2+半径为__pm,已知晶体密度为dg/cm3,S2-半径为apm。(写计算表达式)。

【答案】3d10 O>N>C>H sp3 甘氨酸是极性分子,且分子中的氨基、羧基都能与水分子形成氢键 5 12mol 形成该离子化合物阴阳离子所带电荷数少,离子半径大,形成离子晶体的晶格能小,熔点低 四面体 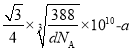
【解析】
(1)Zn2+核外有28个电子,电子排布式是[Ar]3d10;同周期元素从左到右,电负性增大;
(2)甘氨酸(H2N-CH2-COOH)中N原子形成3个单键,有1个孤电子对,价电子对数是4;甘氨酸和水分子之间能形成氢键;
(3)根据结构简式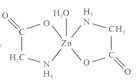 判断Zn2+的配位数;
判断Zn2+的配位数;
(4)单键全是σ键、双键中有1个σ键、1个π键;
(5)常温下IMI的某种衍生物与甘氨酸形成的离子化合物为液态而非固态,说明晶格能小;
(6)①根据晶胞图回答;
②根据晶胞密度,可计算晶胞的边长;若要使S2-、Zn2+相切,则体对角线的长等于2个Zn2+和2个S2-直径的和。
(1)Zn2+核外有28个电子,电子排布式是[Ar]3d10,价电子排布式是3d10;一水合甘氨酸锌中所涉及的非金属元素是H、C、N、O,同周期元素从左到右,电负性增大,电负性由大到小的顺序是O>N>C>H;
(2)甘氨酸(H2N-CH2-COOH)中N原子形成3个单键,有1个孤电子对,所以杂化轨道类型为sp3;甘氨酸是极性分子,且分子中的氨基、羧基都能与水分子形成氢键,所以甘氨酸易溶于水;
(3)根据结构简式 ,可知Zn2+的配位数是5;
,可知Zn2+的配位数是5;
(4)单键全是σ键、双键中有1个σ键、1个π键,根据结构简式![]() ,可知1molIMI中含有12molσ键;
,可知1molIMI中含有12molσ键;
(5)形成该离子化合物阴阳离子所带电荷数少,离子半径大,形成离子晶体的晶格能小,熔点低,所以常温下IMI的某种衍生物与甘氨酸形成的离子化合物为液态而非固态;
(6)①根据晶胞图,Zn2+填入S2-组成的四面体空隙中;
②设晶胞的边长为xpm,则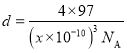 ,x=
,x=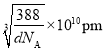 ,体对角线为
,体对角线为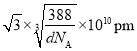 ;若要使S2-、Zn2+相切,则体对角线的长等于2个Zn2+和2个S2-直径的和,则Zn2+半径为
;若要使S2-、Zn2+相切,则体对角线的长等于2个Zn2+和2个S2-直径的和,则Zn2+半径为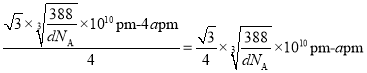 。
。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中国古代陶瓷烧制工艺的珍品“唐三彩”中的蓝色,其釉料的着色剂是一种含钴矿物。钴在制取颜料和制备合金方面有着重要的应用,回答下列问题。
(1)基态Co2+的核外电子排布式为__________,基态Co原子中空间运动状态不同的电子数为___种。
(2)配合物[Co(NH3)5Br](NO3)2中存在的化学键类型有__________,配体NH3中配位原子的杂化轨道类型为__________,NO3-的空间构型是__________,第一电离能N__________(填“大于”或“小于”)O。
(3)CoO2具有如图所示的层状结构(小球表示Co,大球表示O)。下列用粗实线画出的结构单元不能描述其化学组成的是__________(填字时代号)。
A.  B.
B. 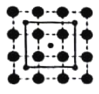 C.
C. 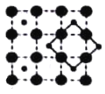 D.
D. 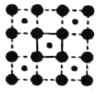
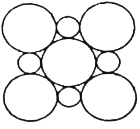
(4)MgO具有NaCl型结构(示意图如图所示),其中阴离子采用面心立方最密堆积方式,X射线衍射实验测得MgO的晶胞参数为a=0.420nm,则r(O2-)为________ nm(结果保留三位小数,下同)。CoO也属于NaCl型结构,晶胞参数为a'=0.488 nm,则r(Co2+)为________ nm
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.1mol以CnHmCOOH所表示的羧酸加成时需50.8g碘,0.1mol该羧酸完全燃烧时,产生CO2和H2O共3.4mol,该羧酸是( )
A. C15H27COOHB. C15H31COOH
C. C17H31COOHD. C17H33COOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用煤油作溶剂,二(2-乙基己基)磷酸酯作流动载体,H2SO4 作内相酸处理含铜废水。 在其他条件相同时,Cu2+萃取率[萃取率=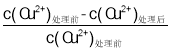 ×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
×100% ]与初始 Cu2+浓度关系如图 1 所示;在其他条件相同时,处理前初始 Cu2+浓度为 200 mg·L-1,Cu2+萃取率与废水 pH 的关系如图 2 所示。下列说法错误的是
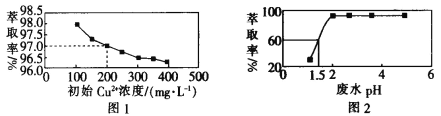
A.根据图 1 可知,废水中初始 Cu2+浓度越大,Cu2+的萃取效果越好
B.根据图 2 可知,废水初始 pH>2 时,去除 Cu2+的效果较好
C.根据图 1 可知,Cu2+初始浓度为 200 mg·L-1 时,Cu2+的萃取率为 97.0%
D.根据图 2 可知,若取 800 mL 初始 Cu2+浓度为 200 mg·L-1 的废水,在 pH=1.5 时处理废水,则处理后的废水中剩余 Cu2+的物质的量为 1.5×10-3mol(假设体积不变)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中序号分别代表某一元素。请回答下列问题。
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑨ | |||||
3 | ① | ③ | ④ | ⑤ | ⑧ | |||
4 | ② |
(1)①~⑨中,最活泼的金属元素是________,最不活泼的元素是______。(写元素符号)。
(2)⑦和⑧的气态氢化物,更稳定的是_____(写电子式)。
(3)原子半径:①_____⑥(填“>
(4)①~⑧的最高价氧化物对应的水化物中:酸性最强的是_____(填化学式,下同);碱性最强的是_______,具有两性的是_______。
(5)①的最高价氧化物对应的水化物与⑧的气态氢化物水溶液发生反应,其离子方程式是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2019年为元素周期表年,元素周期表是学习物质结构和性质的重要工具,下图是元素周期表的一部分,表中所列字母A、D、F、G、Q、M、R、N、T分别代表某种化学元素。请依据这9种元素回答下列问题。
A | ||||||||
D | F | |||||||
G | Q | M | R | |||||
N | ... ... | T | ||||||
(1)表中金属性最强的元素是___(填元素符号),它在元素周期表中的位置是____。
(2)元素的非金属性:Q___F(填“>”或“<”)。
(3)D的最高价氧化物对应水化物的化学式是______。
(4)F、G两元素可形成的淡黄色固体物质,该物质含有的化学键的类型是_和__。
(5)表中某元素原子的核外电子层数是最外层电子数的3倍,该元素的原子结构示意图为_。
(6)表中M、R和N元素的原子都可形成与Ar具有相同电子层结构的简单离子,这些离子的半径由大到小的顺序是_____(填离子符号)。
(7)A与D形成分子的空间结构可能是(填序号)____。
a ![]() b
b ![]() c
c 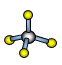 d
d 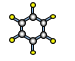
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸性锌锰干电池是一种一次电池,外壳为金属锌,中间是碳棒,其周围是碳粉,MnO2,ZnCl2和NH4Cl等组成的糊状填充物,该电池在放电过程产生MnOOH,回收处理该废电池可得到多种化工原料,有关数据如表所示:
溶解度/(g/100g水)
0 | 20 | 40 | 60 | 80 | 100 | |
NH4Cl | 29.3 | 37.2 | 45.8 | 55.3 | 65.6 | 77.3 |
ZnCl2 | 343 | 395 | 452 | 488 | 541 | 614 |
溶度积常数
化合物 | Zn(OH)2 | Fe(OH)2 | Fe(OH)3 |
Ksp近似值 | 10-17 | 10-17 | 10-39 |
回答下列问题:
(1)该电池的正极反应式为______,电池反应的离子方程式为____
(2)维持电流强度为0.5A,电池工作五分钟,理论上消耗Zn_____g。(已经F=96500C/mol)
(3)废电池糊状填充物加水处理后,过滤,滤液中主要有ZnCl2和NH4Cl,二者可通过____分离回收;滤渣的主要成分是MnO2、______和______,欲从中得到较纯的MnO2,最简便的方法是_____________,其原理是_______/span>。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为周期表的一部分,其中的编号代表对应的元素。
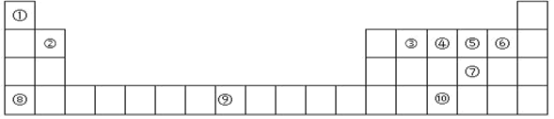
(1)在①~⑩元素的电负性最大的是_____(填元素符号)。
(2)⑨元素有_____种运动状态不同的电子。
(3)⑩的基态原子的价电子排布图为_____。
(4)⑤的氢化物与⑦的氢化物比较稳定的是_____,沸点较高的是_____(填化学式)。
(5)上述所有元素中的基态原子中 4p轨道半充满的是_____(填元素符号),4s轨道半充满的是_____(填元素符号)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com