
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
如下实验操作正确且能达到实验目的的是( )
A.用铁粉与稀硝酸反应,制取少量氢气,用排水法收集
B.在蒸发皿中给十水碳酸钠加热脱水
C.用酸式滴定管量取6.55 mL的KMnO4溶液
D.将碘水倒入分液漏斗,加适量乙醇,振荡后静置,可将碘萃取到乙醇中
查看答案和解析>>
科目:高中化学 来源: 题型:
下列存在丁达尔现象的分散系是( )
①有尘埃的空气 ②溴水 ③蒸馏水 ④沸水中加入适量饱和FeCl3的溶液至溶液变为透明的红褐色液体 ⑤淀粉的溶液
A.①②③⑤ B.①④⑤ C.②③ D.②③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述中,正确的是
A.糖类化合物都具有相同的官能团
B.乙醇和汽油都是可再生能源,所以要大力发展“乙醇汽油”
C.蛋白质的水解产物都含有羧基和羟基
D.油脂的种类很多,但它们水解后都一定有一产物相同
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)高温电解技术能高效实现CO2(g) + H2O(g) ==CO(g) + H2(g) +O2(g) ,工作原理示意图如下:

① 电极b发生 (填“氧化”或“还原”)反应。
② CO2在电极a放电的反应式是 。
(2)工业上用某矿渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取铜的操作流程如下:

已知: Cu2O + 2H+ = Cu + Cu2+ + H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 开始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
①固体混合物A中的成分是 。
②反应Ⅰ完成后,铁元素的存在形式为 。(填离子符号)
请写出生成该离子的离子方程式 。
③x的数值范围是3.2≤pH<4.0,y对应的数值范围是 。
④下列关于NaClO调pH的说法正确的是 (填序号)。
a. 加入NaClO可使溶液的pH降低
b. NaClO能调节pH的主要原因是由于发生反应ClO-+ H+ HClO,
HClO,
ClO-消耗H+,从而达到调节pH的目的
c .NaClO能调节pH的主要原因是由于NaClO水解ClO-+ H2O HClO+OH-,
HClO+OH-,
OH-消耗H+ ,从而达到调节pH的目的
⑤ 实验室配制质量分数为20.0%的CuSO4溶液,配制该溶液所需的CuSO4·5H2O与H2O的质量之比为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应的离子方程式正确的是 ( )
A.乙酸乙酯与氢氧化钠溶液反应:CH3COOCH2CH3 + OH-—→ CH3COO- + CH3CH2O- + H2O
B.醋酸溶液与新制氢氧化铜反应:2H++Cu(OH)2 —→ Cu2++2H2O
C.苯酚钠溶液中通入少量二氧化碳:2 +CO2+H2O
+CO2+H2O  2
2 +CO
+CO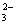
D.乙醛溶液与新制氢氧化铜悬浊液共热CH3CHO+2Cu(OH)2+OH_ CH3COO-+ Cu2O↓+ 3H2O
CH3COO-+ Cu2O↓+ 3H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
学习硝酸的强氧化性后,某学习小组进行浓硝酸和硫单质反应的实验探究。他们根据氧化还原反应原理推测硫的氧化产物,提出三种假设:Ⅰ、只有H2SO4;Ⅱ、只有SO2;Ⅲ、 SO2和H2SO4都有。为探究是哪一种情况,他们设计下列实验流程及步骤:

① 实验所得气体折算成标准状况下物质的量为0.08mol
② 混合气体用水吸收后,测得无含硫、含氮化合物逸出,并将吸收液配成100.00mL溶液
③ 取②中所得溶液20.00mL,加足量BaCl2溶液得白色沉淀0.466g
④ 另取②中所得溶液20.00mL,用NaOH溶液中和,恰好用去0.6mol/LNaOH溶液30.00mL。请回答下列问题:
(1)混合气体中NO2气体被水充分吸收的化学方程式为 。
(2)②中配制溶液所用到的玻璃仪器除烧杯、量筒外还有 。
(3)收集到的气体中含有 ,进而可证明 (填“Ⅰ、Ⅱ或Ⅲ”)成立。
(4)配制的100.00mL溶液中H+的物质的量浓度是 ,该实验中浓硝酸和硫反应的化学方程式为: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com