
| A. | 过氧化钠与水反应生成2.24 L O2时转移的电子数为0.2NA | |
| B. | 1 L 14 mol/L硝酸与足量铜反应生成气体分子数小于7NA | |
| C. | 1 L1 mol/L NaHS溶液中H2S、HS-和S2-粒子数之和为NA | |
| D. | 1 mol OH-的电子总数比1 mol-OH的电子总数多NA |
分析 A、氧气所处的状态不明确;
B、铜和浓硝酸反应生成的NO2气体中存在平衡:2NO2?N2O4;
C、HS-既能水解又能电离;
D、羟基含9个电子,而氢氧根中含10个电子.
解答 解:A、氧气所处的状态不明确,故其物质的量无法计算,则转移的电子数无法计算,故A错误;
B、当铜和14mol浓硝酸反应全部生成NO2时,得到的NO2的物质的量为7mol,但足量铜和浓硝酸反应开始生成二氧化氮,后来生成NO甚至铵盐,且生成的NO2气体中存在平衡:2NO2?N2O4,导致所生成的分子个数小于7NA个,故B正确;
C、HS-既能水解为H2S又能电离为S2-,根据物料守恒可知,H2S、HS-和S2-粒子数之和为NA,故C正确;
D、羟基含9个电子,而氢氧根中含10个电子,故1mol氢氧根中的电子数为10NA个,而1mol羟基中的电子数为9NA个,即多NA个,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 可用湿润的淀粉碘化钾试纸检验产物Q | |
| B. | K2FeO4在水中的电离方程式为K2FeO4→2K++Fe6++4O2一 | |
| C. | 反应中氧化剂与还原剂的物质的量之比为1:3 | |
| D. | 反应中涉及的物质中有5种为电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C4H10有三种同分异构体 | |
| B. | 乙醇、乙二醇、丙三醇互为同系物,同系物之间不可能为同分异物体 | |
| C. | 常温下2S2O(g)=3S(s)+SO2(g)能自发进行,可推断该反应为放热反应 | |
| D. | 因为合金在潮湿的空气中易形成原电池,所以合金耐腐蚀性都较差 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
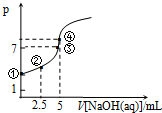 常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )
常温下向10mL 0.1mol•L-1HN3(叠氮酸)溶液中逐滴滴加0.2mol•L-1的NaOH溶液,溶液pH的变化曲线如图所示(溶液混合时体积的变化、温度忽略不计,HN3的Ka=10-4.7).下列说法不正确的是( )| A. | 水电离出的c(OH-):①点小于 ③点 | |
| B. | 此反应的滴定实验宜选用甲基橙做指示剂 | |
| C. | ②点时c(N3-)>c(Na+)>c(HN3)>c(H+)>c(OH-) | |
| D. | ④点时c(Na+)=c(N3-)+c(HN3)=$\frac{1}{15}$mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
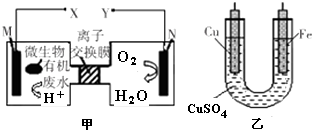
| A. | 铜电极应与X相连接 | |
| B. | H+透过离子交换膜由N极向M极移动 | |
| C. | M电极反应式:(C6H10O5)n+7n H2O-24n e-═6n CO2↑+24n H+ | |
| D. | 当N电极消耗0.25 mol气体时,则铁电极增重16 g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1 mol/L NH4HCO3溶液中:K+、Na+、NO3-、Cl- | |
| B. | $\frac{{k}_{W}}{c({H}^{+})}$=1×10-13 mol/L的溶液中:NH4+、Na+、SiO32-、Cl- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 水电离的c(H+)=1×10-13mol/L的溶液中:K+、Na+、AlO2-、CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 植物的秸秆、枝叶、杂草和人畜粪便等生物质在沼气池中经发酵可生成沼气 | |
| B. | Al(OH)3、Fe(OH)3等胶体具有很强的吸附能力,可用于净水 | |
| C. | 鸡蛋清中加入浓食盐水析出沉淀、75%乙醇溶液进行消毒、福尔马林用于浸制生物标本,其中蛋白质都发生了变性 | |
| D. | 塑料袋、废纸、旧橡胶制品等属于有机物,可以回收利用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
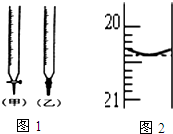 某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:
某校化学兴趣小组采用酸碱中和滴定法用0.1000mol/LNaOH溶液滴定待测盐酸溶液,试回答下面的问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com