
【题目】研究+6价铬盐不同条件下微粒存在形式及氧化性,某小组同学进行如下实验:
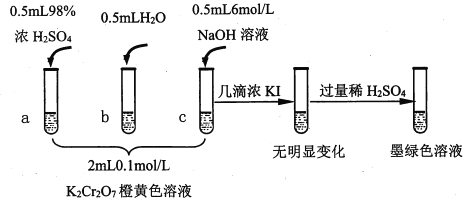
已知:Cr2O72- (橙色)+H2O![]() 2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
2CrO42-(黄色)+2H+ △H= +13.8 kJ/mol,+6价铬盐在一定条件下可被还原为Cr3+,Cr3+在水溶液中为绿色。
(1)试管c和b对比,推测试管c的现象是________。
(2)试管a和b对比,a中溶液橙色加深。甲认为温度也会影响平衡的移动,橙色加深不一定是c(H+)增大影响的结果;乙认为橙色加深一定是c(H+)增大对平衡的影响。你认为是否需要再设计实验证明?____(“是”或“否”),理由是_________________________________。
(3)对比试管a、b、c的实验现象,得到的结论是________________。
(4)试管c继续滴加KI溶液、过量稀H2SO4,分析上图的实验现象,得出的结论是_______;写出此过程中氧化还原反应的离子方程式________________。
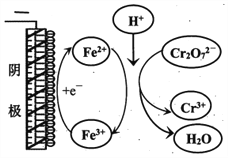
(5)小组同学用电解法处理含Cr2O72-废水,探究不同因素对含Cr2O72-废水处理的影响,结果如下表所示(Cr2O72-的起始浓度,体积、电压、电解时间均相同)。
实验 | ⅰ | ⅱ | ⅲ | ⅳ |
是否加入Fe2(SO4)3 | 否 | 否 | 加入5g | 否 |
是否加入H2SO4 | 否 | 加入1mL | 加入1mL | 加入1mL |
电极材料 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴、阳极均为石墨 | 阴极为石墨,阳极为铁 |
Cr2O72-的去除率/% | 0.922 | 12.7 | 20.8 | 57.3 |
①实验ⅱ中Cr2O72-放电的电极反应式是________________。
②实验ⅲ
【答案】 溶液变黄色 否 Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+ 2H+正向是吸热反应,若因浓H2SO4溶于水而温度升高,平衡正向移动,溶液变为黄色。而实际的实验现象是溶液橙色加深,说明橙色加深就是增大c(H+)平衡逆向移动的结果 碱性条件下,+6价铬主要以CrO42-存在;酸性条件下,主要以Cr2O72-存在 碱性条件下,CrO42-不能氧化I-;酸性条件下,Cr2O72-能氧化I-。(或Cr2O72-氧化性强于CrO42-) 6I-+ Cr2O72-+14H+==3I2+ 2Cr3++ 7H2O Cr2O72-+ 6e一+14H+==2Cr3++ 7H2O 阳极Fe失电子生成Fe2+,Fe2+与Cr2O72-在酸性条件下反应生成Fe3+,Fe3+在阴极得电子生成Fe2+,继续还原Cr2O72-,Fe2+循环利用提高了Cr2O72-的去除率
2CrO42-(黄色)+ 2H+正向是吸热反应,若因浓H2SO4溶于水而温度升高,平衡正向移动,溶液变为黄色。而实际的实验现象是溶液橙色加深,说明橙色加深就是增大c(H+)平衡逆向移动的结果 碱性条件下,+6价铬主要以CrO42-存在;酸性条件下,主要以Cr2O72-存在 碱性条件下,CrO42-不能氧化I-;酸性条件下,Cr2O72-能氧化I-。(或Cr2O72-氧化性强于CrO42-) 6I-+ Cr2O72-+14H+==3I2+ 2Cr3++ 7H2O Cr2O72-+ 6e一+14H+==2Cr3++ 7H2O 阳极Fe失电子生成Fe2+,Fe2+与Cr2O72-在酸性条件下反应生成Fe3+,Fe3+在阴极得电子生成Fe2+,继续还原Cr2O72-,Fe2+循环利用提高了Cr2O72-的去除率
【解析】(1)针对Cr2O72- (橙色)+H2O![]() 2CrO42-(黄色)+2H+反应来说,试管c中加入碱,消耗了H+,平衡右移,溶液变黄色;正确答案:溶液变黄色。
2CrO42-(黄色)+2H+反应来说,试管c中加入碱,消耗了H+,平衡右移,溶液变黄色;正确答案:溶液变黄色。
(2)Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+ 2H+正向是吸热反应,若因浓H2SO4溶于水而温度升高,平衡正向移动,溶液变为黄色。而实际的实验现象是溶液橙色加深,说明橙色加深就是增大c(H+)平衡逆向移动的结果;正确答案:否;Cr2O72-(橙色)+H2O
2CrO42-(黄色)+ 2H+正向是吸热反应,若因浓H2SO4溶于水而温度升高,平衡正向移动,溶液变为黄色。而实际的实验现象是溶液橙色加深,说明橙色加深就是增大c(H+)平衡逆向移动的结果;正确答案:否;Cr2O72-(橙色)+H2O![]() 2CrO42-(黄色)+ 2H+正向是吸热反应,若因浓H2SO4溶于水而温度升高,平衡正向移动,溶液变为黄色。而实际的实验现象是溶液橙色加深,说明橙色加深就是增大c(H+)平衡逆向移动的结果。
2CrO42-(黄色)+ 2H+正向是吸热反应,若因浓H2SO4溶于水而温度升高,平衡正向移动,溶液变为黄色。而实际的实验现象是溶液橙色加深,说明橙色加深就是增大c(H+)平衡逆向移动的结果。
(3)对比试管a、b、c的实验现象,得到的结论在酸碱性不同的情况下,溶液中主要存在的离子不同;碱性条件下,+6价铬主要以CrO42-存在;酸性条件下,主要以Cr2O72-存在;正确答案:碱性条件下,+6价铬主要以CrO42-存在;酸性条件下,主要以Cr2O72-存在。
(4)从实验现象分析可知:碱性条件下,CrO42-不能氧化I-,所以无明显变化;酸性条件下,Cr2O72-能氧化I-,本身被还原为Cr3+,变为墨绿色溶液;此过程中氧化还原反应的离子方程式:. 6I-+ Cr2O72-+14H+==3I2+ 2Cr3++ 7H2O ;正确答案:碱性条件下,CrO42-不能氧化I-;酸性条件下,Cr2O72-能氧化I-。(或Cr2O72-氧化性强于CrO42-);6I-+ Cr2O72-+14H+==3I2+ 2Cr3++ 7H2O。
(5)①实验ⅱ中Cr2O72-在阴极被还原为Cr3+,电极反应式Cr2O72-+ 6e一+14H+==2Cr3++ 7H2O;正确答案:Cr2O72-+ 6e一+14H+==2Cr3++ 7H2O。
②根据图示分析可知:阳极Fe失电子生成Fe2+,Fe2+与Cr2O72-在酸性条件下反应生成Fe3+,Fe3+在阴极得电子生成Fe2+,继续还原Cr2O72-,Fe2+循环利用提高了Cr2O72-的去除率;正确答案:阳极Fe失电子生成Fe2+


 提分百分百检测卷系列答案
提分百分百检测卷系列答案 宝贝计划期末冲刺夺100分系列答案
宝贝计划期末冲刺夺100分系列答案 能考试全能100分系列答案
能考试全能100分系列答案科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的脱氧剂,其制备方法是向Na2CO3溶液中通入SO2,生成NaHSO3和CO2,一定条件下NaHSO3转化为Na2S2O5。
完成下列填空:
(1)碳原子的原子结构示意图是____________。氧原子核外能量不同的电子有_____种。CO2的电子式是_________________。
(2)从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。______________________
(3)SO2与Na2CO3溶液反应生成NaHSO3和CO2,其化学方程式为_______________。
证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是________。
(4)Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+H2O→Na2SO4+H2SO4,该反应中,氧化产物是_____;若反应中转移了0.04 mol的电子,有____g Na2S2O5参加反应。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2002年诺贝尔化学奖获得者的贡献之一是发明了对有机物分子进行结构分析的质谱法。其方法是让极少量的(10-9g)化合物通过质谱仪的离子化室使样品分子大量离子化,少量分子碎裂成更小的离子。如C2H6离子化后可得到C2H6+、C2H5+、C2H4+……,然后测定其质荷比。某有机物样品的质荷比如下图所示(假设离子均带一个单位正电荷,信号强度与该离子的多少有关),则该有机物可能是( )


A. 甲醇 B. 丙烷 C. 甲烷 D. 乙烯
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将7g某铜、银合金与足量的amol/LHNO3充分反应,完全溶解后放出的气体与标准状况下的氧气0.56L混合,通入水中恰好完全吸收,则此合金中银的质量是( )
A.1.6gB.2.7gC.3.2gD.5.4g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硒及其化合物在工农业生产中有重要用途,硒也是人体必需的微量元素。
(1)硒(34Se)在周期表中位于硫下方,画出其原子结构示意图_____________。
(2)氧族元素单质均能与H2反应生成H2X,用原子结构解释原因_______________。
(3)298K、1.01×l0-5Pa,O2、S、Se、Te分别与H2化合的反应热数据如图所示。写出Se与H2化合的热化学反应方程式__________________。
(4)可以从电解精炼铜的阳极泥中提取硒,通过化学工艺得到亚硒酸钠等含硒物质。常温下,Se(Ⅳ)溶液中各组分的物质的量分数随pH变化曲线如图。
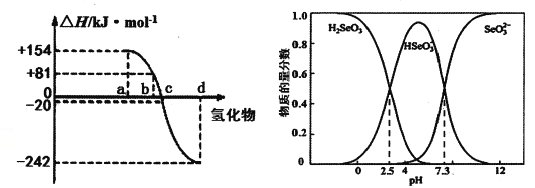
①向亚硒酸溶液滴入NaOH溶液至pH =5,该过程中主要反应的离子方程式________。
②在pH<0的酸性环境下,向Se(Ⅳ)体系中通入SO2制得单质Se的化学方程式是_______。
③下列说法正确的是____(填字母序号)。
a.NaHSeO3溶液显酸性
b.pH=8时,溶液中存在c(HAsO3-)+2c(SeO32-)+c(OH-)=c(H+)
c.在Na2SeO3溶液中,c(SeO32-》c(HSeO3-)> c(H2SeO3)
④常温下,H2SeO3的第二步电离平衡常数为K2,计算K2=________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】请用学过的化学知识对下面实验进行分析。

(1)图甲所示实验过程中,铜电极发生反应的电极反应式为______。银电极上发生______(填“氧化”、“还原”)反应。
(2)图乙所示实验过程中b试管的现象是_____________________________。
(3)图丙所示实验过程中c 为电源的_____极。溶液中滴加酚酞溶液,则____极区(填“石墨”、“铁棒”)溶液变红。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】鲨鱼是世界上唯一不患癌症的动物,科学研究表明,鲨鱼体内含有一种角鲨烯,具有抗癌性。已知鲨烯分子含30个C原子及6个碳碳双键且不含环状结构,则其分子式为( )
A.C30H60B.C30H56C.C30H52D.C30H50
查看答案和解析>>
科目:高中化学 来源: 题型:
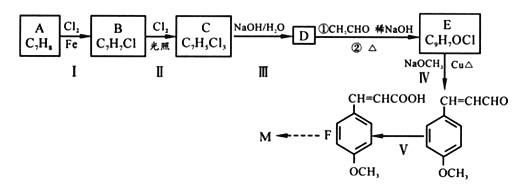
【题目】[化学一有机化学基础]
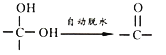
防晒剂(M)CH3O![]() CH=CHCOOCH2CH2CH2CH3的合成路线如下,根据信息回答下列问题:
CH=CHCOOCH2CH2CH2CH3的合成路线如下,根据信息回答下列问题:
已知:(1)通常在同一个碳原子上连有两个羟基不稳定,易脱水形成羰基;
(2)![]()
(1)M中醚键是一种极其稳定的化学键,除此之外还含有官能团的名称为_______________。
(2)A的核磁共振氢谱中显示有_____种吸收峰;物质B的名称______________。
(3)C 的结构简式______;D→E转化过程中第①步的化学反应方程式____________________。
(4)完成V的反应条件是_________;IV 的反应类型为______________________。
(5)A也是合成阿司匹林(![]() )的原料,
)的原料,![]() 有多种同分异构体。写出符合下列条件的同分异构体的结构简式____________(任写出一种 )。
有多种同分异构体。写出符合下列条件的同分异构体的结构简式____________(任写出一种 )。
a.苯环上有3 个取代基 b.仅属于酯类,能发生银镜反应,且每摩该物质反应时最多能生成4molAg c.苯环上的一氯代物有两种
(6)以F及乙醛为原料,合成防哂剂CH3O![]() CH=CHCOOCH2CH2CH2CH3的路线为_______(用流程图表示)。流程示例:CH2=CH2
CH=CHCOOCH2CH2CH2CH3的路线为_______(用流程图表示)。流程示例:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com