
【题目】下列各组离子,在溶液中能大量共存的是( )
A. S2-、Na+、SO32-、H+ B. Na+、HCO3-、Cl-、OH-
C. Na+、Al3+、Cl-、SO42- D. H+、Fe2+、NO3-、SO42-
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:
【题目】乌洛托品在合成、医药、染料等工业中有广泛用途,其结构简式如图所示。将甲醛水溶液与氨水混合蒸发可制得乌洛托品。若原料完全反应生成乌洛托品,则甲醛与氨的物质的量之比应为( )
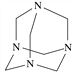
A. 1∶1 B. 2∶3
C. 3∶2 D. 2∶1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是某化学兴趣小组探究不同条件下化学能转变为电能的装置。请回答下列问题:
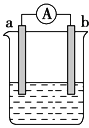
(1)当电极a为Al,电极b为Mg,电解质溶液为稀硫酸时,该电池的正极为________ (填元素符号),负极的电极反应式为:__________________。
(2)当电极a为Al,电极b为Mg,电解质溶液为氢氧化钠溶液时,该电池的正极为____(填元素符号),负极的电极反应式为:__________________ 。
(3)铅蓄电池是常用的化学电源,其电极材料分别是Pb和PbO2,电解液为硫酸。该电池总反应式为:Pb+PbO2+2H2SO4![]() 2PbSO4+2H2O。请根据上述情况判断:
2PbSO4+2H2O。请根据上述情况判断:
①该蓄电池放电时,电解质溶液中阴离子移向_____(填“正极”或“负极”);正极附近溶液的酸性_________(填“增强”、“减弱”或“不变”)放电时,负极的电极反应式为:__________________(用离子方程式表示)。
②实验室用铅蓄电池作电源电解饱和食盐水制取氯气,今若制得0.050 mol Cl2,这时电池内消耗的H2SO4的物质的量至少是____________。氢氧燃料电池具有启动快、效率高等优点,其能量密度高于铅蓄电池。若电解质为KOH溶液,则氢氧燃料电池的负极反应式为______________。该电池工作时,外电路每流过1 mol e-,消耗标况下氧气_________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,CO2与NH3反应可制得重要的化工产品三聚氰胺:3NH3 + 3CO2![]()
 +3H2O。
+3H2O。
(1)基态N原子的价层电子排布图为____________,三聚氰胺的几种组成元素中电负性由大到小的顺序为____________(用元素符号表示)。
(2)三聚氰胺中氮原子的杂化轨道类型为____________。
(3)上述合成三聚氰胺的反应过程中存在多种类型化学键的断裂与形成,但这些化学键中不包括____________(填选项字母)。
a.α键 b.π键 c.非极性共价键 d.极性共价键
(4)三聚氰胺的熔点为250 ℃,则其晶体类型是____________,又知硝基苯的熔点为5.7 ℃,异致这两种物质熔点差异的原因是____________。
(5)随者科学技术的发展,科学家们已合成了由碳、氧两种元素形成的原子晶体.其晶胞结构如图(a) 所示:若晶胞参数为a pm,设NA表示阿伏加德罗常数的值,则该晶胞的密度是____________ g cm-3。
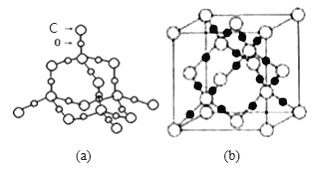
(6)SiO2晶体结构片断如图 (b)所示。通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能。
化学键 | Si-O | Si-Si | O=O |
键能/ KJ·mol-1 | 460 | 176 | 498 |
Si(s)+O2(g)![]() SiO2(s),该反应的反应热△H = ___________
SiO2(s),该反应的反应热△H = ___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种用于治疗高血脂的新药灭脂灵(Hepronicate)是按如下路线合成的:
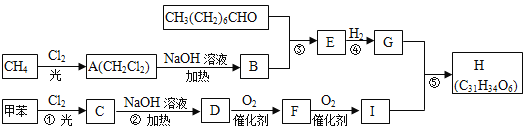
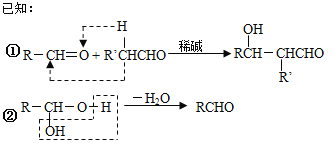
试回答:
(1)写出结构简式:E_________;E中所含官能团的名称是_______________________.
(2)上述①至⑤反应中属于取代反应的是_____________(填序号);
(3)写出反应方程式:
Ⅰ.反应②______________________________________________;
Ⅱ.反应⑤_______________________________________________;
Ⅲ.B与新制的Cu(OH)2悬浊液反应:____________________;
(4)分子式与I相同,属于芳香族化合物的同分异构体有_________种(不含其它的环不包括I)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E五种元素,其原子序数依次增大。C元素的单质是生活中最常见的助燃剂。A与C形成的一种化合物是引起温室效应的主要气体。D与C同主族。E是我国最早使用的合金的主要成分。根据上述信息回答下列问题:
(1)写出E元素外围电子排布式:_______________。
(2)A、B、C三种元素中电负性最大的是:___________,
第一电离能最大的是:_________(填元素符号)。
(3)D元素气态氢化物的分子构型是:__________,其键角______109°28′(填“大于”“小于”或“等于”)。D元素在其最高价氧化物分子中的杂化方式为:_________。
(4)E元素形成的单质晶体类型为:___________晶体,假设其原子半径为r pm,NA为阿伏加德罗常数,则其晶体密度的表达式为ρ=________________g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 将w g a%的NaCl溶液蒸发掉![]() g水,得到2a%的NaCl溶液
g水,得到2a%的NaCl溶液
B. 将1Lc mol/L的硫酸溶液用4L水稀释,稀释后溶液的物质的量浓度等于0.2c mol/L
C. 标准状况下,将a L HCl气体溶于1 L水中,所得溶液密度为d g/mL,则此溶液的物质的量浓度为
![]()
D. 将1.6 g CuSO4·5H2O晶体溶于水配成1L溶液,制得0.01 mol/L的CuSO4溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分子式为C8H16O2的有机物A,它能在酸性条件下水解生成B和C,且B在一定条件下能转化成C。则有机物A的可能结构有( )
A.1种B.2种C.3种D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有一含NaCl、Na2CO3·10H2O和NaHCO3的混合物,某同学设计如图所示的实验装置,通过测量反应产生的CO2和H2O的质量,来确定该混合物中各组分的质量分数。
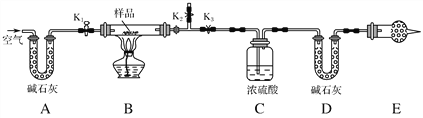
(1)实验步骤:
①按图(夹持仪器未画出)组装好实验装置后,首先进行的操作是_________。
②称取样品,并将其放入硬质玻璃管中;称量装浓硫酸的洗气瓶C的质量和装碱石灰的U形管D的质量。
③打开活塞K1、K2,关闭K3,缓缓鼓入空气数分钟,其目的是________________。
④关闭活塞K1、K2,打开K3,点燃酒精灯加热至不再产生气体。装置B中发生反应的化学方程式为_________________________________________。
⑤打开活塞K1,缓缓鼓入空气数分钟,然后拆下装置,再次称量洗气瓶C的质量和U形管D的质量。
(2)关于该实验方案,请回答下列问题。
①若加热反应后不鼓入空气,对测定结果的影响是___________________。
②E处干燥管中盛放的药品是________,其作用是__________________ ________________,如果实验中没有该装置,则会导致测量结果NaHCO3的质量________(填“偏大”、“偏小”或“无影响”)。
③若样品质量为w g,反应后C、D装置增加的质量分别为m1 g、m2 g,则混合物中Na2CO3·10H2O的质量分数为________(用含w、m1、m2的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com