
【题目】某化学反应的反应物和产物如下,请按要求回答下列问题![]() :
:
(1)如果该化学方程式中S和![]() 的系数分别是5和1,请配平化学方程式
的系数分别是5和1,请配平化学方程式![]() ,并用单线桥标出电子转移的方向和数目:______。
,并用单线桥标出电子转移的方向和数目:______。
(2)该反应中,发生氧化反应的物质是___,该反应中,发生还原反应的过程是____。
(3)反应中,1mol还原剂________![]() 填“得到”或“失去”
填“得到”或“失去”![]() ________mol电子。
________mol电子。
(4)若在标准状况下,反应产生336ml气体,则转移的电子数为________个。
(5)如果没有对该化学方程式中的某些化学计量数做限定,配平的化学计量数有许多组,原因是________________。
【答案】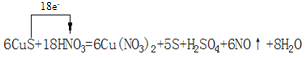
![]()
![]() 失去 3
失去 3 ![]() 该反应的氧化产物有两种,两种氧化产物的化学计量数有许多组。
该反应的氧化产物有两种,两种氧化产物的化学计量数有许多组。
【解析】
(1)已知S和![]() 的系数分别是5和1,S化合价升高,共失18电子,依据电子守恒,可确定NO的化学计量数为6,从而配平方程式。再据单线桥的书写原则,写出表示式;
的系数分别是5和1,S化合价升高,共失18电子,依据电子守恒,可确定NO的化学计量数为6,从而配平方程式。再据单线桥的书写原则,写出表示式;
(2)S元素化合价升高,CuS发生氧化反应,发生还原反应过程为HNO3生成NO;
(3)CuS发生氧化反应,由(1)可知,6CuS失去18电子,则可求出1mol还原剂平均失电子的数目;
(4)标准状况下,反应产生336ml气体,即![]() ,则可求出转移的电子数;
,则可求出转移的电子数;
(5)没有对该化学方程式中的某些化学计量数做限定,配平的化学计量数有许多组,原因是该反应的氧化产物有两种,发生的两个独立反应间没有定量关系。
(1)已知S和![]() 的系数分别是5和1,根据配平原则进行配平,S化合价升高失电子,N化合价降低得电子,反应中转移18电子,则有单线桥法表示为:
的系数分别是5和1,根据配平原则进行配平,S化合价升高失电子,N化合价降低得电子,反应中转移18电子,则有单线桥法表示为: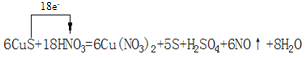 ,故答案为:
,故答案为: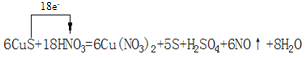 ;
;
(2)S元素化合价升高,CuS发生氧化反应,N化合价降低,![]() 发生还原反应,故答案为:CuS;
发生还原反应,故答案为:CuS;![]() ;
;
(3)CuS发生氧化反应,还原剂为CuS,则1mol还原剂平均失去3mol电子,故答案为:失去;3;
(4)标准状况下,反应产生336ml气体,336mlNO气体的物质的量为0.015mol,则转移的电子数为![]() ,故答案为:
,故答案为:![]() ;
;
(5)没有对该化学方程式中的某些化学计量数做限定,配平的化学计量数有许多组,原因是该反应的氧化产物有两种,两种氧化产物的化学计量数有许多组,故答案为:该反应的氧化产物有两种,两种氧化产物的化学计量数有许多组。


科目:高中化学 来源: 题型:
【题目】如图所示,隔板I固定不动,活塞Ⅱ可自由移动,M、N两个容器中均发生反应:A(g)+2B(g)![]() xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
xC(g)△H=﹣192kJmol﹣1,向M、N中都通入1mol A和2mol B的混合气体,初始M、N容积相同,保持温度不变.下列说法正确的是( )
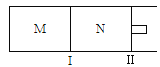
A. 若x=3,达到平衡后A的体积分数关系为:φ(M)>φ(N)
B. 若x>3,达到平衡后B的转化率关系为:α(M)>α(N)
C. 若x<3,C的平衡浓度关系为:c(M)>c(N)
D. x不论为何值,起始时向N容器中充入任意值的C,平衡后N容器中A的浓度均相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaClO是漂白液的有效成分,某研究小组探究NaClO溶液的性质,设计了下列实验:
装置图 | 试剂X | 实验现象 | |
|
|
| 产生黄绿色气体 |
|
| 溶液变蓝 | |
|
| 溶液变红 | |
|
| 产生白色沉淀 | |
下列判断不正确的是![]()
![]()
A.实验![]() 中发生的主要反应是
中发生的主要反应是![]()
B.实验![]() 中发生的主要反应是
中发生的主要反应是![]()
C.实验![]() 中该条件下氧化性强弱
中该条件下氧化性强弱![]()
D.实验![]() 中
中![]() 与
与![]() 相互促进水解
相互促进水解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求书写反应的化学方程式或离子方程式:
(1)某地污水中的有机污染物主要成分是三氯乙烯![]() ,向此污水中加入
,向此污水中加入![]() 高锰酸钾被还原为
高锰酸钾被还原为![]() 溶液可将其中的三氯乙烯除去,氧化产物只有
溶液可将其中的三氯乙烯除去,氧化产物只有![]() ,写出该反应的化学方程式:_____________。
,写出该反应的化学方程式:_____________。
(2)在甲酸钠、氢氧化钠混合溶液中通入二氧化硫气体,可得到重要的工业产品保险粉![]() ,同时产生二氧化碳气体,该反应的离子方程式为_______。
,同时产生二氧化碳气体,该反应的离子方程式为_______。
(3)已知![]() 能与稀硫酸反应,生成一种淡黄色不溶物和一种气体
能与稀硫酸反应,生成一种淡黄色不溶物和一种气体![]() 标准状况下的密度为
标准状况下的密度为![]() ,写出该反应的离子方程式:______。
,写出该反应的离子方程式:______。
(4)一定条件下,向![]() 溶液中滴加碱性
溶液中滴加碱性![]() 溶液,溶液中
溶液,溶液中![]() 元素的化合价为
元素的化合价为![]() 与
与![]() 反应生成纳米铁粉、
反应生成纳米铁粉、![]() 和
和![]() ,其离子方程式为_____________。
,其离子方程式为_____________。
(5)![]() 与碘化钾在稀硫酸中反应的离子方程式为_____________。
与碘化钾在稀硫酸中反应的离子方程式为_____________。
(6)![]() 还原性较强,在溶液中易被
还原性较强,在溶液中易被![]() 氧化成
氧化成![]() ,常用作脱氯剂,该反应的离子方程式为_____________。
,常用作脱氯剂,该反应的离子方程式为_____________。
(7)![]() 可与KOH和
可与KOH和![]() 在高温下反应,生成产物之一为
在高温下反应,生成产物之一为![]() ,反应的化学方程式为_____________。
,反应的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、C、D、E为短周期主族元素,F、G为第四周期元素,它们的原子序数依次增大。
A元素的核外电子数和电子层数相等,也是宇宙中最丰富的元素 |
B元素原子的核外p电子数比s电子数少1 |
C原子的第一至第四电离能分别是:I1=738kJ/mol I2=1451kJ/mol I3=7733kJ/mol I4=10540kJ/mol |
D元素简单离子半径是该周期中最小的 |
E元素是该周期电负性最大的元素 |
F所在族的元素种类是周期表中最多的 |
G在周期表的第十一列 |
(1)已知BA5为离子化合物,写出其电子式__。
(2)B基态原子中能量最高的电子,其电子云在空间有__个方向,原子轨道呈__形。
(3)实验室制备E的单质的离子反应方程式为__。
(4)BE3在常温下是一种淡黄色的液体,其遇水即发生反应可生成一种具有漂白性的物质,写出反应的化学方程式__;该反应说明其中B和E中非金属性较强的是__填元素的符号。
(5)C与D的第一电离能大小为__。D与E的最高价氧化物对应水化物相互反应的离子方程式为__。
(6)G价电子排布图为__,位于__纵行。F元素的电子排布式为__,前四周期中未成对电子数最多的元素在周期表中位置为__(填周期和族)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NaClO溶液吸收NO尾气,可提高尾气中NO的去除率。其他条件相同时,NO(转化为![]() )的转化率随NaClO溶液初始pH用稀硫酸调节
)的转化率随NaClO溶液初始pH用稀硫酸调节![]() 的变化如图所示。下列说法正确的是
的变化如图所示。下列说法正确的是
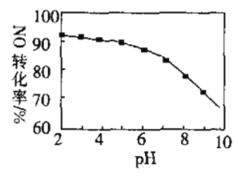
A.HClO氧气NO的能力比NaClO强
B.向NaClO溶液中通入NO后,溶液pH增大
C.若要吸收4.48LNO,则消耗3molNaClO
D.NaClO溶液中有![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:2Fe3++SO32-+H2O![]() 2Fe2++SO42-+2H+,如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,A是灵敏电流表,其指针总是偏向电源负极,A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是( )
2Fe2++SO42-+2H+,如图所示是一套电化学实验装置,图中C、D均为铂电极,U为盐桥,A是灵敏电流表,其指针总是偏向电源负极,A杯中为FeCl3溶液;B杯中为Na2SO3溶液。以下关于该装置的说法错误的是( )
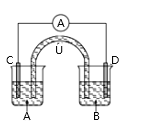
A.A指针向右偏转
B.U中阳离子向左烧杯移动
C.一段时间后,化学反应达到平衡状态,导线中无电流通过
D.一段时间后,右烧杯中溶液pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学对电化学原理进行了一系列探究活动。

(1)如图所示为某实验小组设计的原电池装置,依据的氧化还原为(用离子反应方程式表示)_____________________________________。
反应前,电极质量相等,一段时间后,两电极质量相差12 g,导线中通过_____mol电子。
(2)其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为________,这是由于NH4Cl溶液显____(填“酸性”“碱性”或“中性”),用离子方程式表示溶液显此性的原因:_____________________,用吸管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,然后滴加几滴硫氰化钾溶液,溶液变红,继续滴加过量新制饱和氯水,颜色褪去,同学们对此做了多种假设,某同学的假设是:“溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式:_________________________________________。

(3)如图其他条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示。一段时间后,在甲装置铜丝附近滴加酚酞溶液,现象是________________,电极反应为_________________________;乙装置中石墨(1)为____(填“正”“负”“阴”或“阳”)极,乙装置中与铜丝相连石墨电极上发生的反应式为________________,产物常用___________________ 检验,反应的离子方程式为 _____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】①已知t℃时AgCl的Ksp=2×10-10;②在t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )

A.在t℃时,Ag2CrO4的Ksp为1×10-9
B.在饱和Ag2CrO4溶液中加入K2CrO4可使溶液由Y点到X点
C.在t℃时,以0.01 mol/LAgNO3溶液滴定20 mL 0.01 mol/L KCl和0.01 mol/L的K2CrO4的混和溶液,CrO42-先沉淀
D.在t℃时,反应Ag2CrO4(s)+2Cl-(aq)![]() 2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
2AgCl(s)+CrO42-(aq)的平衡常数K=2.5×107
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com