
 过程中,设计了如下实验方案:
过程中,设计了如下实验方案: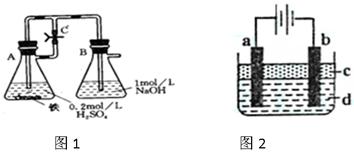
 活力课时同步练习册系列答案
活力课时同步练习册系列答案科目:高中化学 来源:不详 题型:填空题
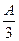 g,则溶液中的阳离子一定有 、可能有 、一定没有 。
g,则溶液中的阳离子一定有 、可能有 、一定没有 。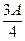 g,则溶液中的阳离子一定有 、一定没有 。
g,则溶液中的阳离子一定有 、一定没有 。 查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题
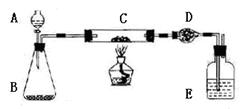
| 步骤 | 实验过程 | 实验现象 | 有关化学方程式 |
| 1 | |  | .com |
| 2 | 在C中加入样品W克,D中装入碱石 灰后并称量为m1克。连接好仪器,打开A的活塞,慢慢加溶液。 | | |
| 3 | 对C进行加热。当C中药品充分反应后。关闭A的活塞。停止加热: | | |
| 4 | 冷却后,称量D的质量为m2克。 |  |  |
查看答案和解析>>
科目:高中化学 来源:不详 题型:实验题


| 实验步骤 | 实验操作 | 实验现象 |
| Ⅰ | 将反应后得到黑色粉末X(假定为均匀的),取出少量放入另一试管中,加入少量盐酸,微热 | 黑色粉末逐渐溶解,溶液呈浅绿色;有少量气泡产生 |
| Ⅱ | 向实验I中得到的溶液滴加几滴KSCN溶液,振荡 | 溶液没有出现红色 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.有8.4g铜生成 |
| B.有8g氧化铜参加反应 |
| C.有1.6g水生成 |
| D.有10g氧化铜被还原 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题




查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.若无铜析出,则溶液中有Cu2+、Fe2+,可能有Fe3+ |
| B.若有铜析出,则溶液中含有Fe2+,没有Cu2+和Fe3+ |
| C.若铁有剩余,则溶液中含有Fe2+,没有Cu2+和Fe3+ |
| D.若铁无剩余,则溶液中含有Fe2+,无Fe3+,可能含有Cu2+ |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.7:1 | B.7:8 | C.1:7 | D.8:21 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com