(2010?诸城市模拟)研究化学反应对人类社会的发展进步有重要意义.
(1)已知:N
2(g)+3H
2(g)2NH
3(g)△H
1=-92.4kJ/mol
2H
2(g)+O
2(g)=2H
2O(g)△H
2=-523.6kJ/mol
H
2O(g)=H
2O(l)△H
3=-44.0kJ/mol
根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N
2在催化剂(掺有少量Fe
2O
3的TiO
2)表面与水发生反应生成氨气,试写出此反应的热化学方程式
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=-1650kJ/mol
2N2(g)+6H2O(l)=4NH3(g)+3O2(g)△H=-1650kJ/mol
.
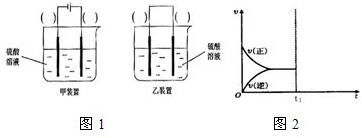
(2)现有反应:Cu+H
2SO
4═CuSO
4+H
2,欲通过如图1所示装置实现上述反应,请选择合适的装置在括
号内标出电极材料(填“Cu”或“C”),并且写出C电极上的电极反应式
2H++2e-→H2↑
2H++2e-→H2↑
.
(3)长期使用的锅炉需要定期除水垢,否则会降低燃料的利用率.水垢中含有的CaSO
4,可先用Na
2CO
3溶液处理,使之转化为疏松、易溶于酸的CaCO
3,而后用酸除去.则CaSO
4 转化为CaCO
3的离子方程式为
CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq)
CaSO4(s)+CO32-(aq)=CaCO3(s)+SO42-(aq)
.
(4)科学研究发现纳米级Cu
2O的可作为太阳光分解水的催化剂.一定温度下,在2L密闭容器中加入纳米级Cu
2O并通入0.10mol水蒸气,发生反应:2H
2O(g)
2H
2(g)+O
2(g)△H>0,不同时段产生O
2的量见下表:
| 时间/min |
20 |
40 |
60 |
80 |
| n(O2)/mol |
0.0010 |
0.0016 |
0.0020 |
0.0020 |
则:
①该条件下上述反应的化学平衡常数K=
1.7×10-6mol/L
1.7×10-6mol/L
;
②若达到平衡后在t
1时刻保持温度不变,将容器的体积缩小,请在图2中画出正、逆反应速率随时间变化的关系图.

![]() 4NH3(g)+3O2(g)此反应的ΔS________0(填“>”、“<”或“=”)ΔH________.
4NH3(g)+3O2(g)此反应的ΔS________0(填“>”、“<”或“=”)ΔH________.![]() 2NH3(g) ΔH=-92.4 kJ/mol 2H2(g)+O2(g)
2NH3(g) ΔH=-92.4 kJ/mol 2H2(g)+O2(g)![]() 2H2O(1)ΔH=-571.6 kJ/mol)
2H2O(1)ΔH=-571.6 kJ/mol)
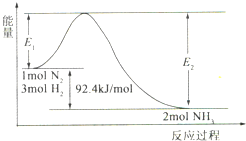 (2012?石家庄模拟)科学家一直致力于“人工固氮”的方法研究.
(2012?石家庄模拟)科学家一直致力于“人工固氮”的方法研究.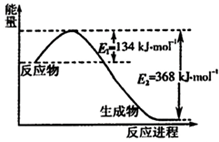 氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.
氮是地球上含量丰富的元素,氮及其化合物的研究在生产、生活中有着重要意义.