
【题目】NA为阿伏加德常数的值。下列叙述中正确的是( )
A.标准状态下,11.2LH2含有的中子数为NA
B.常温下,27gAl投入足量浓硝酸中充分反应,转移的电子数为3NA
C.一个Cu原子的质量为ag,则mg铜的物质的量为![]() mol
mol
D.含2molCH3COO-的CH3COONa溶液中Na+的数目为2NA
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.![]() 、
、![]() 都是极性分子
都是极性分子
B.KF是离子化合物,HF为共价化合物
C.在![]() 和
和![]() 中都存在配位键
中都存在配位键
D.![]() 和
和![]() 分子中所有原子的最外层都达到8电子稳定结构
分子中所有原子的最外层都达到8电子稳定结构
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废金属屑中主要成分为Cu、Fe和Al(含有少量Al2O3和Fe2O3),某化学兴趣小组设计了如下实验流程,用该工厂的合金废料制取氯化铝、绿矾晶体(FeSO4·7H2O)和胆矾晶体。
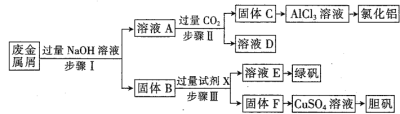
请回答:
(1)胆矾的化学式为___________________。
(2)溶液E为绿色溶液,则试剂X是______________。
(3)步骤I,首先加入温热NaOH溶液,作用是_________;-段时间后,再分批加入常温NaOH溶液,原因是___________。
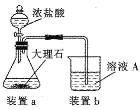
(4)在步骤II时,用如图装置制取CO2并通入溶液A中。-段时间后,观察到烧杯中产生的白色沉淀会逐渐减少。为避免固体C减少,可在a和b间加-个盛有饱和_________溶液的洗气瓶。
(5)保存FeSO4溶液时,需要滴加少量硫酸溶液,再加入适量_______(填化学式),防止变质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工肾脏可用电化学方法除去代谢产物中的尿素[CO(NH2)2],原理如图,下列有关说法不正确的是( )
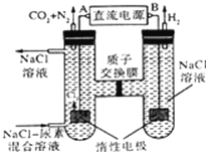
A.B为电源的正极
B.电解结束后,阴极室溶液的pH与电解前相比将升高
C.电子移动的方向是B→右侧惰性电极,左侧惰性电极→A
D.阳极室中发生的反应依次为2Cl﹣﹣2e﹣=Cl2↑、CO(NH2)2+3Cl2+H2O═N2+CO2+6HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随着时代的发展,绿色环保理念越来越受到大家的认同,变废为宝是我们每一位公民应该养成的意识。某同学尝试用废旧的铝制易拉罐作为原材料、采用“氢氧化铝法”制取明矾晶体并进行一系列的性质探究。
制取明矾晶体主要涉及到以下四个步骤:
第一步:铝制品的溶解。取一定量铝制品,置于250mL锥形瓶中,加入一定浓度和体积的强碱溶液,水浴加热(约93℃),待反应完全后(不再有氢气生成),趁热减压抽滤,收集滤液于250mL烧杯中;
第二步:氢氧化铝沉淀的生成。将滤液重新置于水浴锅中,用3 mol/L H2SO4调节滤液pH至8~9,得到不溶性白色絮凝状Al(OH)3,减压抽滤得到沉淀;
第三步:硫酸铝溶液的生成。将沉淀转移至250mL烧杯中,边加热边滴入一定浓度和体积的H2SO4溶液;
第四步:硫酸铝钾溶液的形成。待沉淀全部溶解后加入一定量的固体K2SO4,将得到的饱和澄清溶液冷却降温直至晶体全部析出,减压抽滤、洗涤、抽干,获得产品明矾晶体[KAl(SO4)2·12H2O,M=474g/mol]。
回答下列问题:
(1)第一步铝的溶解过程中涉及到的主要反应的离子方程式为__________________________
(2)为了加快铝制品的溶解,应该对铝制品进行怎样的预处理:________________________
(3)第四步操作中,为了保证产品的纯度,同时又减少产品的损失,应选择下列溶液中的___(填选项字母)进行洗涤,实验效果最佳。
A.乙醇 B.饱和K2SO4溶液 C.蒸馏水 D.1:1乙醇水溶液
(4)为了测定所得明矾晶体的纯度,进行如下实验操作:准确称取明矾晶体试样4.0g于烧杯中,加入50mL 1mol/L盐酸进行溶解,将上述溶液转移至100mL容量瓶中,稀释至刻度线,摇匀;移取25.00 mL溶液干250 mL锥形瓶中,加入30 mL 0.10mol/L EDTA-2Na标准溶液,再滴加几滴2D二甲酚橙,此时溶液呈黄色;经过后续一系列操作,最终用0.20 mol/L锌标准溶液滴定至溶液由黄色变为紫红色,达到滴定终点时,共消耗5.00 mL锌标准溶液。滴定原理为H2Y2-+Al3+→AlY-+2H+,H2Y2-(过量)+Zn2+→ZnY2-+2H+(注:H2Y2-表示EDTA-2Na标准溶液离子)。则所得明矾晶体的纯度为_________%。
(5)明矾除了可以用作人们熟悉的净水剂之外,还常用作部分食品的膨松剂,例如油条(饼)的制作过程需要加入一定量的明矾,请简述明矾在面食制作过程作膨松剂的原理:_______
(6)为了探究明矾晶体的结晶水数目及分解产物,在N2气流中进行热分解实验,得到明矾晶体的热分解曲线如图所示(TG%代表的是分解后剩余固体质量占样品原始质量的百分率,失重百分率=![]() ×100%):
×100%):
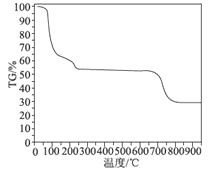
根据TG曲线出现的平台及失重百分率,30~270℃范围内,失重率约为45.57%,680~810℃范围内,失重百分率约为25.31%,总失重率约为70.88%,请分别写出所涉及到30~270℃、680~810℃温度范围内这两个阶段的热分解方程式:___________、_____________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用如图所示的装置实现“路线图”中的部分转化,下列叙述错误的是( )
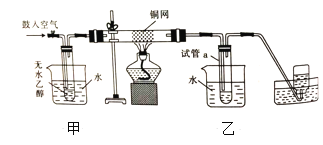
A. 铜网表面乙醇发生氧化反应
B. 甲、乙烧杯中的水均起冷却作用
C. 试管a收集的液体中至少有两种有机物
D. 实验开始后熄灭酒精灯,铜网仍能红热,说明发生的是放热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示为常见气体制备、干燥、性质验证和尾气处理的部分仪器装置(加热设备及夹持固定装置均略去),请根据要求完成下列各题,仪器装置可任意选用,必要时可重复选择。
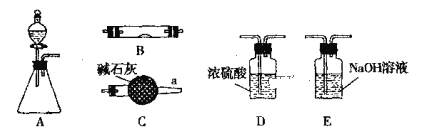
(1)若锥形瓶中盛装锌片,分液漏斗中盛装稀硫酸,可验证H2的还原性并检验其氧化产物。
①当仪器连接顺序为A→D→B→B→C时,两次使用B装置,其中所盛的药品依次是CuO、____________。
②检查好装置的气密性后加热B前必须进行的操作是_________________ 。
(2)若锥形瓶中盛装Na2O2固体,分液漏斗中盛装浓氨水,B中盛装固体催化剂,可进行氨的催化氧化,其反应产物为NO和H2O。
①各仪器装置按气流方向从左到右连接顺序A→C→B→C,请写出B中氨的催化氧化反应方程式____________________________ 。
②装置B中可能观察到的现象是_____________________________。
(3)若锥形瓶中盛装Na2SO3固体,分液漏斗中盛装H2SO4溶液,B中盛装Na2O2固体,可探究SO2气体与过氧化钠反应时是否有O2生成。根据气流方向,装置的连接顺序为:A→D→B→E,根据实验现象回答问题:
①若将带余烬的木条靠近E的导管口,木条复燃,SO2表现酸性氧化物的性质,则反应的方程式可能为:____________________;
②若在E的导管口未收集到任何气体,SO2只表现还原性,则反应的方程式可能为:____________________。
③装置B中观察到的现象是__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、铬及其相关化合物用途非常广泛。回答下列问题:
(1)基态N原子的核外电子排布式为___,Cr位于元素周期表第四周期___族。
(2) Cr与K位于同一周期且最外层电子数相同,两种元素原子第一电离能的大小关系为___;Crcl3的熔点(83℃)比CrF3的熔点(1100℃)低得多,这是因为___。
(3) Cr的一种配合物结构如图所示:

①阴离子C1O4-的空间构型为___形。
②配离子中,中心离子的配位数为___,N与中心原子形成的化学键称为___键。
③配体H2 NCH2 CH2 NH2(乙二胺)中碳原子的杂化方式是______ ,分子中三种元素电负性从大到小的顺序为___
(4)氮化铬的熔点为1770℃,它的一种晶体的晶胞结构如图所示,其密度为5. 9 g·cm -3,氮化铬的晶胞边长为___(列出计算式)nm.

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组对一含有Al3+的未知溶液进行了如下分析:①滴入少量氢氧化钠溶液,无明显变化;②继续滴加氢氧化钠溶液,开始产生白色沉淀;③滴入过量的氢氧化钠溶液,白色沉淀明显减少。实验小组经定量分析,绘出沉淀的物质的量与滴入氢氧化钠体积的关系图。则下列说法中错误的是( )

A. 该未知溶液中至少含有3种阳离子
B. 滴加的NaOH溶液的物质的量浓度为5 mol/L
C. 若另一种离子为二价阳离子,则a=5
D. 最终得到的沉淀,其成分无法确定
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com