
| A. | 盛放NaOH溶液的试剂瓶用磨口玻璃塞 | |
| B. | 氢氟酸保存在塑料瓶中 | |
| C. | 过氧化钠保存在广口瓶中 | |
| D. | 浓盐酸保存在细口试剂瓶中 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
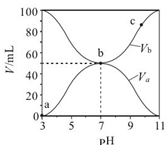
| A. | Ka(HA)=10-6 mol•L-1 | |
| B. | b 点时,c(B+)=c(A-)=c(H+)=c(OH-) | |
| C. | c 点时,$\frac{c({A}^{-})}{c(O{H}^{-})•c(HA)}$随温度升高而减小 | |
| D. | a→c 过程中水的电离程度始终增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
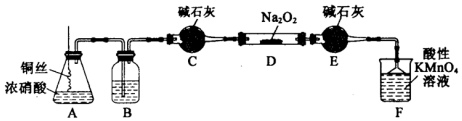
| 滴定次数 | 1 | 2 | 3 | 4 |
| 消耗KMn04溶液体积/mL | 20.90 | 20.12 | 20.00 | 19.88 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 图I研究的是温度对反应的影响,且乙的温度较高 | |
| B. | 图Ⅱ研究的是压强对反应的影响,且甲的压强较高 | |
| C. | 图III研究的是温度对反应的影响,且乙的温度较低 | |
| D. | 图IV研究的是不同催化剂对反应的影响,且甲使用的催化剂效率较低 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
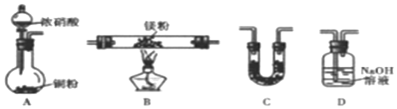
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②④ | B. | ②③⑤ | C. | ②④⑤⑥ | D. | ③④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
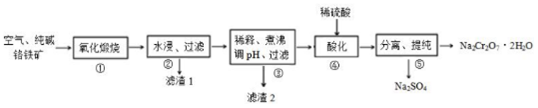
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
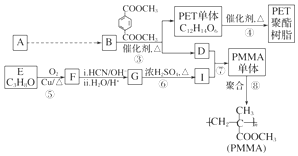
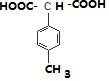 ,
, ,
,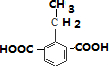 ,
, .
.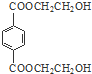 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com