
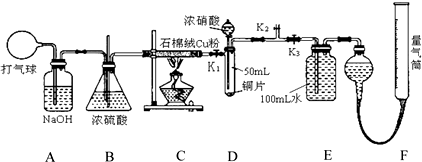
分析 (1)盛装浓硝酸的仪器为分液漏斗,根据影响反应速率的因素分析,增大与氧气接触面积会使反应迅速;
(2)气球中的空气成分主要是氧气、氮气、二氧化碳、水蒸气等,通过氢氧化钠溶液除去二氧化碳,通过浓硫酸除去水蒸气;C装置是反应掉空气中的氧气;D装置是验证铜和浓硝酸反应中可能产生一氧化氮气体,必须保证不能含有氧气,才能在后续试验中通过测定气体体积判断一氧化氮气体的存在,所以D中充满氮气体积为50ml;按照气体流向进行开关的操作;
(3)D中发生的反应一定是铜和浓硝酸的反应生成二氧化氮气体,同时可能硝酸变稀生成一氧化氮气体;加入四氯化碳的目的是把生成的气体全部排到E中吸收;
(4)根据装置的特点和压强关系进行分析判断;
(5)Ⅰ根据酸碱中和反应的定量关系计算硝酸的浓度;
Ⅱ根据E中生成的硝酸溶液体积为100ml,结合化学方程式计算生成的一氧化氮气体,一氧化氮和氮气的体积之和与收集的气体体积比较判断.
解答 解:(1)盛装浓硝酸的仪器为分液漏斗,将铜粉分散在石棉绒中可以增大铜粉与氧气的接触面积,加快反应速率使反应更充分,
故答案为:分液漏斗;增大铜粉与氧接触面积,使反应迅速、充分;
(2)气球中的空气成分主要是氧气、氮气、二氧化碳、水蒸气等,通过氢氧化钠溶液除去二氧化碳,通过浓硫酸除去水蒸气;C装置是反应掉空气中的氧气,所以进入D装置的气体主要是氮气,试管体积为50ml,进入的氮气体积为50ml,通入氮气目的是把试管中的空气排净,避免生成的一氧化氮气体被氧气氧化为二氧化氮,
故答案为:N2;
(3)关闭K1、K2,打开K3,由分液漏斗向D中滴加浓硝酸,一定发生的反应是铜和浓硝酸反应生成硝酸铜二氧化氮和水,可能发生的反应是浓硝酸变稀后和铜的反应生成硝酸铜一氧化氮和水;D中一定发生反应的离子方程式:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O;通过分液漏斗向D中加入CCl4至满,因为氮气和氮氧化物不溶于四氯化碳,是为了把氮气和生成的气体全部排入到E装置吸收,
故答案为:Cu+2NO3-+4H+=Cu2++2NO2↑+2H2O;
(4)DEF在关闭K3后装置是一套气密性完好的装置,若E中出现倒吸,可以调节F中量气管的液体高度改变压强,向下调节量气管,使E中的压强减少,防止液体进入E发生倒吸,或直接关闭K3,不让液体进入E装置,
故答案为:向下调节量气管(或及时关闭K3);
(5)Ⅰ、E装置所得溶液调节为100ml,取出25.00mL,加两滴酚酞,用0.1000mol•L-1的NaOH溶液滴定,当滴定完成后消耗NaOH溶液18.00mL,由酸碱恰好反应的定量关系可知,设硝酸浓度为C,发生的反应实质是H++OH-=H2O,25.00mL×C=18.00mL×0.1000mol•L-1,C=0.0720mol/L,故答案为:0.0720;
Ⅱ、通过计算分析判断,E装置中生成的硝酸溶液体积为100ml,浓度为0.0720mol/L,所以生成硝酸物质的量为0.0072mol,根据化学方程式3NO2+H2O=2HNO3+NO,生成的一氧化氮气体物质的量为0.0036mol,在标准状况下的体积=0.0036mol×22.4L/mol=0.08064L=80.64ml,加上原来试管中的氮气50ml,共计130.64ml,小于题干中实验测得的气体体积139.00ml.说明铜和浓硝酸反应的过程中生成二氧化氮气体同时也生成了一氧化氮气体,
故答案为:有;E装置中生成100mL、0.0720 mol•L-1硝酸时产生的NO约为80.6 mL,而试管中原有50 mL N2,二者之和小于139.00mL,说明生成NO2的同时有NO生成.
点评 本题考查了硝酸的化学性质应用,量气管的正确使用方法,主要是分析装置中的气体流向和各装置的作用,装置图中的隐含条件气体体积的应用,酸碱反应的计算,关键是整套装置的目的是检验铜和浓硝酸反应过程中 是否有一氧化氮气体的生成,需要保证装置中不能含有氧气,才能准确测得,否则不能计算检验,题目较难,需要具备扎实的基础知识和实验基本操作技能.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
 ,氢元素含量最高的烃的分子式CH4.
,氢元素含量最高的烃的分子式CH4.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
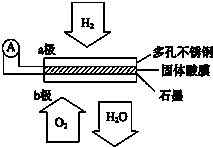 某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )
某固体酸燃料电池以CsHSO4固体为电解质传递H+,其基本结构见如图,电池总反应可表示为:2H2+O2=2H2O,下列有关说法正确的是( )| A. | 电子通过外电路从b极流向a极 | |
| B. | b极上的电极反应式为:O2+2H2O+4e-=4OH- | |
| C. | 每转移0.1 mol电子,消耗标准状况下1.12 L的H2 | |
| D. | OH-由a极通过固体酸电解质传递到b极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲醇、甲醛分子间都可以形成氢键 | |
| B. | 甲醇分子内C原子C原子采取sp2杂化,O原子采取sp杂化 | |
| C. | 甲醛为极性分子,分子中两个C-H键夹角小于120° | |
| D. | 甲醇分子内的O-C-H键角大于甲醛分子内的O-C-H键角 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含非金属元素的化合物不能形成离子键 | |
| B. | 碱金属元素是同周期中金属性最强的元素 | |
| C. | 同种元素的原子均有相同的质子数和中子数 | |
| D. | 卤族元素的阴离子还原性越强,其最高价氧化物水化物的酸性越强 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 是离子化合物,含有离子键和共价键 | |
| B. | 电子式是: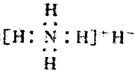 | |
| C. | 与水反应时,是还原剂 | |
| D. | 固体投入少量的水中,有两种气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com