

分析 石英砂和焦炭高温加热反应生成粗硅和一氧化碳,粗硅在流化床反应器中和HCl反应生成SiHCl3和氢气,氢气在后面可以循环利用,在还原炉中被氢气还原生成高纯硅,同时生成HCl可循环利用,
(1)根据盖斯定律可以计算化学反应的焓变;
(2)利用氢气和纯SiHCl3反应制备高纯硅,过程中反应后最后又生成的物质可以循环使用;
(3)根据题目信息和已知条件来书写方程式.
解答 解:(1)根据盖斯定律,反应SiCl4(g)+H2(g)═SiHCl3(g)+HCl(g)可以看成是Si(s)+3HCl(g)═SiHCl3(g)+H2(g)和反应Si(s)+4HCl(g)═SiCl4(g)+2H2(g)的差,所以△H═-210kJ•mol-1-(-241kJ•mol-1)=+31 kJ•mol-1,
故答案为:+31 kJ•mol-1;
(2)利用氢气和纯SiHCl3反应制备高纯硅,反应的化学方程式为:SiHCl3+H2$\frac{\underline{\;1050℃~1100℃\;}}{\;}$Si+3HCl;依据流程关系和反应产物分析,该生产工艺中可以循环使用的物质是 HCl、H2、SiHCl3等;
故答案为:SiHCl3+H2$\frac{\underline{\;1050℃~1100℃\;}}{\;}$Si+3HCl; HCl、H2、SiHCl3等;
(3)硅化镁和固体氯化铵在液氨介质中反应得到硅烷,根据原子守恒,则Mg2Si+4NH4Cl═SiH4↑+2MgCl2+4NH3↑,整个系统还必须与氧隔绝,否则容易发生爆炸,硅化镁和固体氯化铵在水中反应得到硅酸和氢气等,根据原子守恒,则Mg2Si+4NH4Cl+3H2O═2MgCl2+H2SiO3+4NH3↑+4H2↑,
故答案为:Mg2Si+4NH4Cl═SiH4↑+2MgCl2+4NH3↑;Mg2Si+4NH4Cl+3H2O═2MgCl2+H2SiO3+4NH3↑+4H2↑;由于硅烷在空气中易燃,浓度高时容易发生爆炸.
点评 本题是一道有关硅和二氧化硅性质的综合题,难度较大,考查学生分析和解决问题的能力.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸式滴定管用蒸馏水洗净后,直接加入已知物质的量浓度的盐酸 | |
| B. | 锥形瓶用蒸馏水洗净后,直接加入一定体积的未知物质的量浓度的NaOH溶液 | |
| C. | 滴定时,应左手控制活塞,右手摇动锥形瓶,眼睛时刻注视着锥形瓶内颜色的变化 | |
| D. | 读数时,视线与滴定管内液体的凹液面最低处保持一致 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
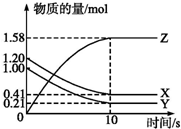 一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:
一定温度下,在2L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
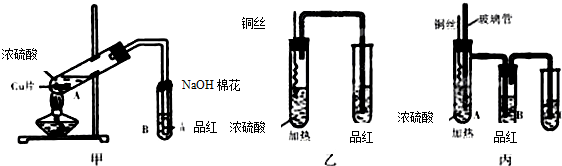
 某化学兴趣小组按如图所示装置探究铜与浓硫酸反应.随着温度的升高,有白雾产生,最终发现铜表面变黑,并有细小黑色颗粒物生成;试管B中有白色沉淀生成.
某化学兴趣小组按如图所示装置探究铜与浓硫酸反应.随着温度的升高,有白雾产生,最终发现铜表面变黑,并有细小黑色颗粒物生成;试管B中有白色沉淀生成.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正逆反应速率都增大 | |
| B. | 平衡不移动 | |
| C. | 再次平衡时c(D) 不变 | |
| D. | C的体积分数不再变化说明再次达到平衡 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 由H+(aq)+OH- (aq)=H2O(l)△H=-57.3 kJ•mol-1:可知含1 mol氢氧化钡的溶液与含0.5 mol硫酸的稀溶液混合,放出热量大于57.3 kJ | |
| B. | 由H2O(g)=H2O(l)△H=-44.0kJ•mol-1可知是放热反应; | |
| C. | 由SO2(g)+$\frac{1}{2}$O2(g)?SO3(g)△H=-98.3 kJ•mol-1可知,在密闭容器中充入2 mol SO2和1 mol O2充分反应后,放出热量为196.6 kJ | |
| D. | 氢气的燃烧热(△H)为-285.5kJ/mo1,则水电解的热化学方程式为:2H2O(1)=2H2(g)+O2(g)△H=+285.5KJ/mo1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com