
| A. | 氧化还原反应的本质是有化合价的升降 | |
| B. | 据丁达尔效应可将分散系分为溶液、胶体与浊液 | |
| C. | 向醋酸溶液中加入少量氢氧化钠溶液,由于发生中和反应,溶液的导电能力降低 | |
| D. | 硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第二位 |
分析 A.氧化还原反应的本质为电子的转移;
B.利用分散质的直径大小将分散系分为溶液、胶体与浊液;
C.醋酸不能完全电离,与NaOH反应生成醋酸钠可完全电离;
D.Si为亲氧元素,在地壳中含量丰富.
解答 解:A.氧化还原反应的本质为电子的转移,特征为化合价变化,故A错误;
B.利用分散质的直径大小将分散系分为溶液、胶体与浊液,丁达尔效应为胶体特有的性质,故B错误;
C.醋酸不能完全电离,与NaOH反应生成醋酸钠可完全电离,离子浓度增大,导电性增强,故C错误;
D.Si为亲氧元素,在地壳中含量丰富,则硅是构成矿物和岩石的主要元素,硅在地壳中的含量在所有的元素中居第二位,故D正确;
故选D.
点评 本题考查氧化还原反应,为高频考点,把握氧化还原反应、分散系、溶液导电性及元素在自然界的存在为解答的关键,侧重分析与应用能力的考查,综合性较强,题目难度不大.


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 分子中的碳原子在一条直线上 | B. | 其一氯代物只有一种 | ||
| C. | 能使酸性高锰酸钾溶液褪色 | D. | 结构简式为CH3 CH2 CH3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2L溶液中阴、阳离子总数为1.2NA | |
| B. | 100mL溶液中NO3-物质的量为为0.4mol | |
| C. | 200mL溶液中Mg2+浓度为0.2mol•L-1 | |
| D. | 500mL溶液中NO3-总数为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2-甲基-2-丁醇 | B. | 2,2-二甲基-1-丁醇 | ||
| C. | 2-甲基-1-丁醇 | D. | 2,3-二甲基-2-丁醇 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
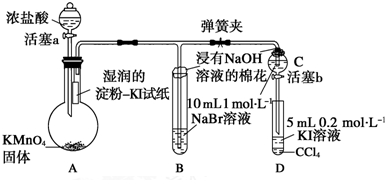
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电解饱和食盐水时,阳极的电极反应式为:2Cl--2e-═Cl2↑ | |
| B. | 碱性氢氧燃料电池的负极反应式:O2+2H2O+4e-═4OH- | |
| C. | 电镀铜时,阳极的反应式:Cu2++2e-═Cu | |
| D. | 钢铁发生电化学腐蚀的负极反应式:Fe-3e-═Fe3+ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com