
| A. | v(NH3)=0.010mol/(L.s) | B. | v(O2)=0.010mol/(L.s) | ||
| C. | v(NO)=0.0010mol/(L.s) | D. | v(H2O)=0.045mol/(L.s) |
分析 根据v=$\frac{△c}{△t}$计算v(H2O),再利用速率之比等于化学计量数之比计算各物质表示的反应速率.进行判断.
解答 解:在体积10L的密闭容器中进行,半分钟后,水蒸气的物质的量增加了0.45mol.
则v(H2O)=$\frac{\frac{0.45mol}{10L}}{30s}$=0.0015mol•L-1•s-1,
A.速率之比等于化学计量数之比,所以v(NH3)=$\frac{2}{3}$×0.0015mol•L-1•s-1=0.0010mol•L-1•s-1,故A错误;
B.速率之比等于化学计量数之比,所以v(O2)=$\frac{5}{6}$×0.0015mol•L-1•s-1=0.00125mol•L-1•s-1,故B错误;
C.速率之比等于化学计量数之比,所以v(NO)=$\frac{2}{3}$×0.0015mol•L-1•s-1=0.0010mol•L-1•s-1,故C正确;
D.v(H2O)=$\frac{\frac{0.45mol}{10L}}{30s}$=0.0015mol•L-1•s-1,故D错误.
故选:C.
点评 本题考查化学反应速率的计算,难度不大,注意公式的运用,化学反应速率的计算通常利用定义法与速率规律计算,根据题目选择合适的计算方法.


科目:高中化学 来源: 题型:多选题
| A. | 加水稀释,盐溶液中各离子的物质的量浓度均将减小 | |
| B. | 常温下反应4Fe(OH)2+O2+2H2O═4Fe(OH)3能自发进行,则△H<0 | |
| C. | 足量的锌与等体积等pH的HA、HB溶液分别反应,HA放出的氢气少说明是强酸 | |
| D. | 反应CaSO4(s)+CO32-(aq)?CaCO3 (s)+SO42-(aq) 的实质就是沉淀溶解平衡的移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
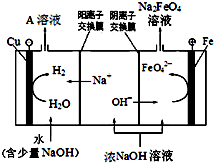 铁及其化合物在生产生活中具有重要的作用.
铁及其化合物在生产生活中具有重要的作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 干冰、液态氯化氢都是电解质 | |
| B. | 根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 | |
| C. | Na2O、Fe2O3、Al2O3既属于碱性氧化物,又属于离子化合物 | |
| D. | Na2O2晶体中既含有离子键又含有共价键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2mol/L | B. | 3mol/L | C. | 4mol/L | D. | 5mol/L |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
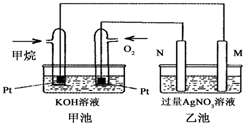 如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:
如图是一个甲烷燃料电池工作时的示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时N电极的质量减少,请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用SO2漂白过的物品在使用过程中会慢慢恢复为漂白前的颜色 | |
| B. | 向含有纯碱的废水中加入适量生石灰,可以消除水中的污染 | |
| C. | 大量焚烧田间秸秆会促进雾霾的形成 | |
| D. | 用热碱水吸收有利于除去手上的油脂形成的污渍 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com