
分布在三个不同短周期的四种元素A、B、C、D的原子序数依次增大,其中B、C同周期,A、D同主族.常温下,BA3溶液的显碱性;C是地壳中含量最高的元素;D是所在周期原子半径最大的元素.下列说法正确的是( )
|
| A. | 原子半径:D>C>B>A |
|
| B. | 气态氢化物的热稳定性:HmB>HnC |
|
| C. | 由A、B、C三种元素形成的化合物均只含有共价键,不含离子键 |
|
| D. | 单质D与水反应放出氢气,当转移2NA个电子时,产生氢气的体积为22. 4升(标准状况) |
考点:
原子结构与元素周期律的关系;原子结构与元素的性质.
分析:
四种元素A、B、C、D的原子序数依次增大,且分布在三个不同短周期,C是地壳中含量最高的元素,则C为O元素;B、C同周期,常温下,BA3溶液的显碱性,则A为H元素、B为N元素;A、D同主族,是所在周期原子半径最大的元素,且原子序数大于氧,故D为Na,据此解答.
解答:
解:四种元素A、B、C、D的原子序数依次增大,且分布在三个不同短周期,C是地壳中含量最高的元素,则C为O元素;B、C同周期,常温下,BA3溶液的显碱性,则A为H元素、B为N元素;A、D同主族,是所在周期原子半径最大的元素,且原子序数大于氧,故D为Na.
A.所有元素中氢原子半径最小,同周期自左而右原子半径减小、同主族自上而下原子半径增大,故原子半径Na>N>O>H,故A错误;
B.非金属性O>N,故氢化物稳定性H2O>NH3,故B错误;
C.由H、N、O三种元素形成的化合物中,硝酸铵中既含有共价键,又含离子键,故C错误;
D.Na与是反应生成NaOH与氢气,当转移2NA个电子时,即转移电子为2mol,根据电子转移守恒可知生成氢气为1mol,在标况下氢气体积为1mol×22.4L/mol=22.4L,故D正确,
故选D.
点评:
本题考查位置结构性质关系,难度不大,推断元素是关键,注意基础知识的全面掌握,知道铵盐中含有离子键和共价键.


科目:高中化学 来源: 题型:
科学家研究发现:等电子体的空间结构相同,则下列有关说法中正确的是( )
|
| A. | BF3和CO32﹣是等电子体,均为平面正三角形结构 |
|
| B. | B3N3H6和苯(C6H6)是等电子体,B3N3H6分子中不存在“肩并肩”式重叠的轨道 |
|
| C. | NH3和PCl3是等电子体,均为三角锥形结构 |
|
| D. | CH4和NH4+是等电子体,键角均为60° |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列实验操作正确的是( )
①用带橡皮塞的棕色试剂瓶存放浓硫酸
②配制100mL质量分数10%的H2O2溶液:取一支规格为100mL的量筒,先取质量分数为30%的双氧水溶液33.3mL,然后再加水至100mL刻度线
③用蒸发皿进行加热蒸发时,不必垫石棉网
④可用FeCl3溶液除去试管内难以刷去的铜迹
⑤欲测某溶液的pH,需先用蒸馏水润湿pH试纸,再用洁净、干燥的玻璃棒蘸取该溶液滴在试纸上,并与标准比色卡比较
⑥分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
⑦蒸馏时,应使温度计水银球靠近蒸馏烧瓶支管口.
|
| A. | ①④ | B. | ②④⑤ | C. | ①③ | D. | ③④⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:
某无色溶液加入铝可以生成氢气,则在该溶液中可能大量存在的离子组是( )
|
| A. | K+、NH4+、NO3﹣、Cl﹣ | B. | Na+、K+、NH4+、Cl﹣ |
|
| C. | NH4+、K+、HCO3﹣、Cl﹣ | D. | Na+、Cu2+、Br﹣、Cl﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
表是元素周期表的一部分,回答下列有关问题:
| 族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | Ⅷ |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ |
(1)写出下列元素符号:① ;⑥ .
(2)画出⑤原子的结构示意图: .
③和⑧元素形成的化合物中含 键.(写化学键类型)
(3)在①﹣﹣⑨的元素中,金属性最强的元素是 ,非金属性最强的元素是 ,最不活泼的元素是 .(均用元素符号表示)
(4)⑧的最高价氧化物对应的水化物化学式是
(5)元素⑦与元素⑧相比,非金属性较强的是 (用元素符号表示),用一化学反应方程式表达这一事实 .
查看答案和解析>>
科目:高中化学 来源: 题型:
肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知:
N2(g) + 2O2(g)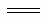 2 NO2(g) ΔH = +67.7kJ/mol
2 NO2(g) ΔH = +67.7kJ/mol
2N2H4(g) + 2NO2(g) 3N2(g)+ 4H2O (g) ΔH = -1135.7kJ/mol
3N2(g)+ 4H2O (g) ΔH = -1135.7kJ/mol
下列说法正确的是
A.N2H4(g) + O2(g) N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
N2(g) + 2H2O(g) ΔH = -1068 kJ/mol
B.肼是与氨类似的弱碱,它易溶于水,其电离方程式:N2H4 + H2O
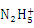 + OH-
+ OH-
C.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,放电时的负极反应式:N2H4-4e- + 4OH- N2 + 4H2O
N2 + 4H2O
D.铂做电极,以KOH溶液为电解质溶液的肼——空气燃料电池,工作一段时间后,KOH溶液的pH将增大
查看答案和解析>>
科目:高中化学 来源: 题型:
关于CH4和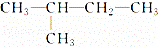 的叙述正确的是( )
的叙述正确的是( )
|
| A. | 通常情况下它们都是气态烷烃 |
|
| B. | 与所有烷烃互为同系物 |
|
| C. | 因为它们结构相似,所以它们的化学性质相似,物理性质相同 |
|
| D. | 均能用CnH2n+2组成通式来表示 |
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于指定粒子构成的叙述中,不正确的是( )
A. 37Cl与39K具有相同的中子数
B. 第114号元素的一种核素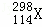 与
与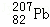 具有相同的最外层电子数
具有相同的最外层电子数
C. O22﹣与S2﹣具有相同的质子数和电子数
D. H3O+与OH﹣具有相同的质子数和电子数
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com