I.下列实验操作、试剂保存方法和实验室事故处理,一定正确的是
AB
AB
(填序号).
A.不慎将浓碱液沾到皮肤上,要立即用大量水冲洗,然后涂上硼酸溶液
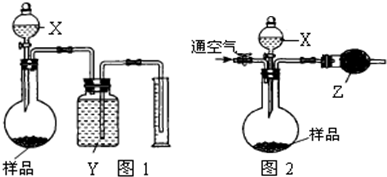
B.制备氢氧化铁胶体时,应向沸水中逐滴滴加1~2mL饱和的FeC1
3溶液,并继续加 热到液体呈透明的红褐色为止
C.测定溶液的pH时,用洁净、干燥的玻璃棒蘸取溶液滴在用蒸馏水湿润过的pH试纸上,并与标准比色卡比较
D.实验室中,浓硝酸保存在带橡胶塞的棕色细口试剂瓶中
E.除去蛋白质溶液中混有的NaC1,可以先加入AgNO
3溶液,然后过滤
F.在进行反应热测定时,为保证实验的准确性,我们可以采取以下具体措施:使用碎泡沫以起到隔热保温的作用、使用铜质搅拌棒进行搅拌、使用的酸碱正好反应、进行两到三次实验,取平均值
II.石灰石的主要成分是碳酸钙,含氧化钙约40~50%,较好的石灰石含CaO约45~53%.此外还有SiO
2、Fe
2O
3、Al
2O
3及MgO等杂质.测定石灰石中钙的含量时将样品溶于盐酸,加入草酸铵溶液,在中性或碱性介质中生成难溶的草酸钙沉淀 (CaC
2O
4?H
2O),将所得沉淀过滤、洗净,用硫酸溶解,用标准高锰酸钾溶液滴定生成的草酸,通过钙与草酸的定量关系,间接求出钙的含量.涉及的化学反应为:H
2C
2O
4+MnO
4-+H
+→Mn
2++CO
2↑+H
2O(未配平).CaC
2O
4 沉淀颗粒细小,易沾污,难于过滤.为了得到纯净而粗大的结晶,通常在含Ca
2+的酸性溶液中加入饱和 (NH
4)
2C
2O
4,由于C
2O
42-浓度很低,而不能生成沉淀,此时向溶液中滴加氨水,溶液中C
2O
42-浓度慢慢增大,可以获得颗粒比较粗大的CaC
2O
4沉淀.沉淀完毕后,pH应在3.5~4.5,这样可避免其他难溶钙盐析出,又不使CaC
2O
4溶解度太大.根据以上材料回答下列问题:
(1)样品溶于盐酸后得到的沉淀物主要是
SiO2
SiO2
(2)沉淀 CaC
2O
4要加入沉淀剂饱和的 (NH
4)
2C
2O
4 溶液,为什么?
保持较大的C2O42-离子浓度,使Ca2+沉淀完全
保持较大的C2O42-离子浓度,使Ca2+沉淀完全
(3)工业中通常先用0.1%草酸铵溶液洗涤沉淀,再用冷的蒸馏水洗涤,其目的是:
降低CaC2O4在水中的溶解度,减少沉淀的损失,降低实验误差
降低CaC2O4在水中的溶解度,减少沉淀的损失,降低实验误差
(4)若开始用去m g样品,最后滴定用去浓度为c mol/L 的KMnO
4 溶液V mL,推出CaO含量与 KMnO
4的定量计算关系.ω%=
.