
| A. | 漂白粉在空气中易变质,所以应密封保存 | |
| B. | 工业上可用铁质容器存放浓硫酸 | |
| C. | 液氯可储存在钢瓶中,便于运输和使用 | |
| D. | 硅酸钠的水溶液俗称“水玻璃”,可保存在带玻璃塞的细口瓶中 |
分析 A.漂白粉在空气中易吸收空气中的二氧化碳和水蒸气反应生成次氯酸见光分解会失效;
B.常温下铁在浓硫酸中发生钝化;
C.常温下氯气和铁不能发生反应;
D.硅酸钠的水溶液俗称“水玻璃”,是矿物胶.
解答 解:A.漂白粉中的次氯酸钙与空气中二氧化碳反应生成不稳定的次氯酸,在空气中易失效,应隔绝空气密封保存,并放置在干燥避光的环境中,故A正确;
B.常温下铁在浓硫酸中发生钝化,表面形成一薄层致密氧化物薄膜阻止反应进行,工业上可用铁质容器存放浓硫酸,故B正确;
C.常温下氯气和铁不能发生反应,液氯可储存在钢瓶中,便于运输和使用,故C正确;
D.硅酸钠的水溶液俗称“水玻璃”,是矿物胶玻璃塞和瓶口易被粘结不容易打开,故D错误;
故选D.
点评 本题考查了物质性质、物质应用、注意知识的积累,掌握基础是解题关键,题目难度中等.


科目:高中化学 来源: 题型:推断题
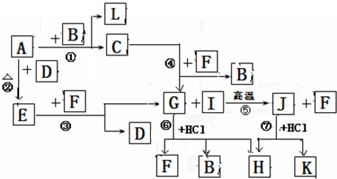
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
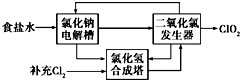 二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.
二氧化氯(ClO2)是一种高效、广谱、安全的杀菌、消毒剂.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| v(mol•L-1•s-1) | c(H2)(mol•L-1) | c(Cl2)(mol•L-1) |
| 1.0k | 1.0 | 1.0 |
| 2.0k | 2.0 | 1.0 |
| 4.0k | 2.0 | 4.0 |
| A. | m=1,n=1 | B. | m=$\frac{1}{2}$,n=$\frac{1}{2}$ | C. | m=$\frac{1}{2}$,n=1 | D. | m=1,n=$\frac{1}{2}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | -5.56×104 kJ•mol-1 | B. | 5.56×104 kJ•mol-1 | ||
| C. | 5.56×104 kJ | D. | -5.56×104 kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用pH计测定0.1mol/L氨水的pH | |
| B. | 用pH试纸测定0.1mol/LNH4Cl溶液的pH | |
| C. | 将氨水连接在一个带灯泡的通电电路中,观察灯泡亮度 | |
| D. | 等浓度、等体积的氨水和NaOH分别与等浓度的盐酸反应,比较消耗盐酸体积的多少 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
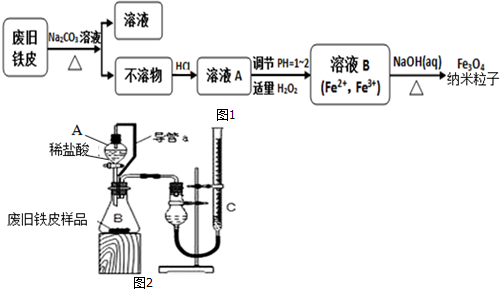
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com