
 ±��Ԫ�صĵ��ʺͻ�����ܶ࣬һ�Ȼ��⣨ICl�������Ȼ��⣨ICl3�����������ǵ�������±�����ƣ���˱���Ϊ±�ػ������������ѧ���ʽṹ�����ʵ����֪ʶ�ش��������⣺
±��Ԫ�صĵ��ʺͻ�����ܶ࣬һ�Ȼ��⣨ICl�������Ȼ��⣨ICl3�����������ǵ�������±�����ƣ���˱���Ϊ±�ػ������������ѧ���ʽṹ�����ʵ����֪ʶ�ش��������⣺ ��HIO4��ǰ��Ϊ��Ԫ�ᣬ����ΪһԪ�ᣮ��Ƚ϶�������ǿ����H5IO6
��HIO4��ǰ��Ϊ��Ԫ�ᣬ����ΪһԪ�ᣮ��Ƚ϶�������ǿ����H5IO6| M |
| NA |
 ���Ц�����м��ĸ�����Ϊ11��1���ʴ�Ϊ������11��1��
���Ц�����м��ĸ�����Ϊ11��1���ʴ�Ϊ������11��1��| 7+1-2��2 |
| 2 |
| 1 |
| 8 |
| 1 |
| 2 |
| 2 |
| 2 |
| m |
| V |
| ||
(
|
| 2 |
| 2 |


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������ǡ����ȫ�к�ʱ����Һ������ |
| B������Һ��c��H+����c��OH-����ȣ���Һ�϶������� |
| C��0.005 mol?L-1 Ba��OH��2��Һ�У�ˮ�������c��OH-��Ϊ10-12 mol?L-1 |
| D��NaCl��Һ��CH3COONH4��Һ�������ԣ�����Һ��ˮ�ĵ���̶���ͬ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
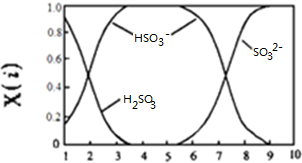
| A��pH=6ʱ��C��H+��=C��SO32-��+C��OH-�� |
| B��pH=2ʱ����Һ�д��ڣ�C��Na+����C��HSO3-����C��H2SO3����C��SO32-�� |
| C����pH=5��NaHSO3��Һ�еμ�һ��Ũ�ȵ�CaCl2��Һ����Һ�л���ֻ�����pHֵ��Ϊ2�������ӷ���ʽ�ɱ�ʾΪ��Ca2++SO32-�TCaSO3 |
| D����ͼ��֪������������Һ������ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� �� | �� | �� |
| ��Ӧ��Ͷ���� | 1molCO2��3molH2 | a molCO2��b molH2�� c molCH3OH��g����c molH2O��g�� |
| ||
| n(H2) |
| n(CO2) |
| n(H2) |
| n(CO2) |

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
 ij��ѧ��ȤС���̼������������������о���ȡ����һЩ�ɹ���
ij��ѧ��ȤС���̼������������������о���ȡ����һЩ�ɹ���
| ||
| ʵ������ | �¶�/�� | ��ʼ��/mol | ƽ����/mol | �ﵽƽ������ʱ��/min | |
| H2O | CO | CO2 | |||
| 1 | 500 | 4 | 8 | 3.2 | 4 |
| 2 | 750 | 2 | 4 | 0.8 | 3 |
| 3 | 750 | 2 | 4 | 0.8 | 1 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��������̼ԭ�Ӷ����õ���sp3�ӻ� |
| B��O2��CO2��N2���ǷǼ��Է��� |
| C�����ԣ�H2CO3��H3PO4��H2SO4��HClO |
| D����̬Feԭ�ӵĵ����Ų�ʽΪ��1s22s22P63s23P64s23d6 |
| E��ˮ���Ӽ�����γ����������ˮ���Ӻ��ȶ��� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���������м���Ũ���ᷢ��һϵ�з�Ӧ��Ũ������Ҫ������ˮ�Ժ����� |
| B�������Ʒ̼����̼Ԫ�ص�һ���µ��ʣ���C60����̼Ԫ�ص�ͬ�������� |
| C�����ǵ�ˮ�����֮һ�ڼ��������¼��ȣ�����������Һ��Ӧ |
| D������ϩ��һ�����͵�ϩ��������ʹ������Ȼ�̼��Һ��ɫ |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
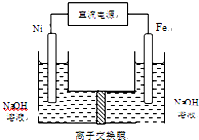 ������������Դ���������й㷺��;��������Ni���������缫���ŨNaOH��Һ�Ʊ��������ƣ�Na2FeO4����װ����ͼ��ʾ������˵����ȷ���ǣ�������
������������Դ���������й㷺��;��������Ni���������缫���ŨNaOH��Һ�Ʊ��������ƣ�Na2FeO4����װ����ͼ��ʾ������˵����ȷ���ǣ�������| A�������������缫��ӦΪFe-2e-+2OH-�TFe��OH��2 |
| B�����һ��ʱ������缫������Һ��pH��С |
| C��ÿ�Ƶ�1mol Na2FeO4�������Ͽ��Բ���67.2L���� |
| D�������ӽ���ĤΪ�����ӽ���Ĥ����������������Һ�к���FeO42- |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A��Cl2+2NaOH�TNaCl+NaClO+H2O | ||||
B��2KClO3
| ||||
C��2KMnO4
| ||||
D��2H2O
|
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com