
(2)NaHCO3溶液中混有少量Na2CO3,除去的方法是加________,化学方程式是 ________________。
(3)NaOH溶液中混有少量Na2CO3,除去的方法是加________溶液或________溶液,
反应的离子方程式是________、________。
| (1) 加热 2NaHCO3 提示:  
练习册系列答案
 阅读快车系列答案 阅读快车系列答案
相关习题
科目:高中化学 来源: 题型: 已知氨水的电离度与醋酸的电离度在同温同浓度下相等,溶有一定量氨的氯化铵溶液呈碱性.现向少量的Mg(OH)2悬浊液中,加入适量的饱和氯化铵溶液,固体完全溶解. 甲同学的解释是.Mg(OH)2(固)?Mg2++2OH-…① NH4++H2O?NH3?H2O+H+…②H++OH-=H2O…③ 由于NH4+水解显酸性,H+与OH-反应生成水,导致反应①平衡右移,沉淀溶解; 乙同学的解释是.Mg(OH)2(固)?Mg2++2OH-…①NH4++OH-?NH3?H2O…② 由于NH4Cl电离出的NH4+与Mg(OH)2电离出的OH-结合,生成了弱的电解质NH3?H2O,导致反应①的平衡右移,Mg(OH)2沉淀溶解. (1)丙同学不能肯定哪位同学的解释合理,于是选用下列的一种试剂,来证明甲、乙两位同学的解释只有一种正确,他选用的试剂是 B B (填写编号).A.NH4NO3 B.CH3COONH4 C.Na2CO3 D.NH3?H2O (2)请你说明丙同学作出该选择的理由 醋酸铵溶液显中性 醋酸铵溶液显中性 (3)丙同学将所选试剂滴入Mg(OH)2的浊液中,Mg(OH)2溶解;由此推知,甲和乙哪位同学的解释更合理 乙 乙 (填“甲”或“乙”);完成NH4Cl饱和溶液使Mg(OH)2悬浊溶解的离子方程式2NH4++Mg(OH)2=2NH3?H2O+Mg2+ 2NH4++Mg(OH)2=2NH3?H2O+Mg2+ .查看答案和解析>> 科目:高中化学 来源: 题型:阅读理解  (2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下: (2010?江苏)高纯MnCO3是制备高性能磁性材料的主要原料.实验室以MnO2为原料制备少量高纯MnCO3的操作步骤如下:(1)制备MnSO4溶液: 在烧瓶中(装置见右图)加入一定量MnO2和水,搅拌,通入SO2和N2混合气体,反应3h.停止通入SO2,继续反应片刻,过滤(已知MnO2+H2SO3=MnSO4+H2O). ①石灰乳参与反应的化学方程式为 SO2+Ca(OH)2=CaSO3+H2O SO2+Ca(OH)2=CaSO3+H2O .②反应过程中,为使SO2尽可能转化完全,在通入SO2和N2比例一定、不改变固液投料的条件下,可采取的合理措施有 控制适当的温度 控制适当的温度 、缓慢通入混合气体 缓慢通入混合气体 . ③若实验中将N2换成空气,测得反应液中Mn2+、SO42-的浓度随反应时间t变化如右图.导致溶液中Mn2+、SO42-浓度变化产生明显差异的原因是 Mn2+催化氧气与亚硫酸反应生成硫酸 Mn2+催化氧气与亚硫酸反应生成硫酸 .(2)制备高纯MnCO3固体:已知MnCO3难溶于水、乙醇,潮湿时易被空气氧化,100℃开始分解;Mn(OH)2开始沉淀时pH=7.7.请补充由(1)制得的MnSO4溶液制备高纯MnCO3的操作步骤[实验中可选用的试剂:Ca(OH)2、NaHCO3、Na2CO3、C2H5OH]. ① 边搅拌边加入碳酸钠或碳酸氢钠,并控制溶液的PH<7.7 边搅拌边加入碳酸钠或碳酸氢钠,并控制溶液的PH<7.7 ;②过滤,用水洗涤2-3次 过滤,用水洗涤2-3次 ;③检验SO42-是否被除去 检验SO42-是否被除去 ;④用少量的乙醇洗涤 用少量的乙醇洗涤 ;⑤低于100℃干燥.查看答案和解析>> 科目:高中化学 来源: 题型:阅读理解 已知NaHCO3低温时溶解度小,侯德榜制碱的方法是:向氨化的饱和食盐水中通入过量的二氧化碳,即有晶体析出,经过滤、洗涤、焙烧得纯碱.此过程可以表示为: ①NaCl (饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl(此反应是放热反应) ②2NaHCO3
现某化学小组根据上述原理在实验室中模拟制碱过程,下图C装置是溶有氨和NaCl的溶液,且二者均达到了饱和.  (1)制CO2时为了使反应随开随用,随关随停,上图A方框内应选用以下 C C 装置.简述该装置随关随停的理由关闭弹簧夹后反应生成的气体上部压强增大,到达一定程度后可把反 应液压回漏斗,使固液分离从而停止反应 关闭弹簧夹后反应生成的气体上部压强增大,到达一定程度后可把反 .应液压回漏斗,使固液分离从而停止反应 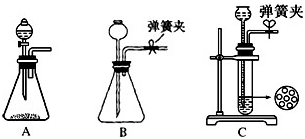 (2)为使实验能够进行,在B、D方框内补上所需装置,并指明所用试剂(将装置图画在答题纸上) (3)完成第(2)步,该小组检验气密性合格后进行实验,发现析出的晶体非常少,在老师的指导下,他们对某个装置进行了改进,达到了实验目的.你认为他们的改进方法是 将C装置浸泡在一个盛有冰水混合物的水槽里(大烧杯) 将C装置浸泡在一个盛有冰水混合物的水槽里(大烧杯) .(4)若所用饱和食盐水中含有NaCl的质量为5.85g,实验后得到干燥的NaHCO3晶体的质量为5.46g,假设第二步分解时没有损失,则Na2CO3的产率为 65% 65% .查看答案和解析>> 科目:高中化学 来源:物理教研室 题型:022 某小化工厂生产皓矾,结晶前的饱和溶液中含有Cu2+、Fe2+、Fe3+等杂质离子,该厂除杂质的工艺流程如图所示。
请参考以下数据(有关氢氧化物从开始到沉淀完全的pH范围): Fe(OH)2 7.6~9.6 Fe(OH)3 2.7~3.7 Zn(OH)25.7~8。除杂质过程中供选用的试剂:漂液(含NaClO 25.2%)、H2O2 (30%)、NaOH (98%)、Na2CO3 (固99.5%)、CaCO3(固99.5%),且Na2CO3和CaCO3在pH<5.6的溶液中发生酸解,生成二氧化碳。试回答:
(1)操作①加铁粉的作用是_______________。 (2)操作②应加入的试剂是_______________,其作用是_____________。 (3)为使杂质离子充分沉淀,需将溶液的pH调节到_____________,操作③就是加入调pH的试剂,该试剂应选用__________。选用的理由是____________。
查看答案和解析>> 科目:高中化学 来源: 题型:043 某小化工厂生产皓矾,结晶前的饱和溶液中含有Cu2+、Fe2+、Fe3+等杂质离子,该厂除杂质的工艺流程如图所示。 请参考以下数据(有关氢氧化物从开始到沉淀完全的pH范围): Fe(OH)2 7.6~9.6 Fe(OH)3 2.7~3.7 Zn(OH)25.7~8。除杂质过程中供选用的试剂:漂液(含NaClO 25.2%)、H2O2 (30%)、NaOH (98%)、Na2CO3 (固99.5%)、CaCO3(固99.5%),且Na2CO3和CaCO3在pH<5.6的溶液中发生酸解,生成二氧化碳。试回答:
(1)操作①加铁粉的作用是_______________。 (2)操作②应加入的试剂是_______________,其作用是_____________。 (3)为使杂质离子充分沉淀,需将溶液的pH调节到_____________,操作③就是加入调pH的试剂,该试剂应选用__________。选用的理由是____________。
查看答案和解析>> 同步练习册答案 湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区 违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com版权声明:本站所有文章,图片来源于网络,著作权及版权归原作者所有,转载无意侵犯版权,如有侵权,请作者速来函告知,我们将尽快处理,联系qq:3310059649。 ICP备案序号: 沪ICP备07509807号-10 鄂公网安备42018502000812号 |