
��Һ������Ũ�ȴ�С�ıȽ�
���Ȼ����Һ�У����й�ϵʽ��ȷ����
A��C(Cl-)��C(NH4+)��C(H+)��C(OH-) B ��C(NH4+)��C(Cl-)��C(H+)��CC(OH-)
������C��C(Cl-)��C(NH4+)��C(H+)��C(OH-) D��C(NH4+)��C(Cl-)��C(H+)��C(OH-)
��0.1 mol/l��NH3��H2O��Һ�У����й�ϵ��ȷ����
��A��C(NH3��H2O)��C(OH-)��C(NH4+)��C(H+) B��C(NH4+)��C(NH3��H2O)��C(OH-)��C(H+)
��C��C(NH3��H2O)��C(NH4+)��C(OH-)��C(H+) D��C(NH3��H2O)��C(NH4+)��C(H+)��C(OH-
�����ʵ�������0.1 mol��CH3COOH��CH3COONa���Ƴ�1L�����Һ����֪����C(CH3COO-)��C(Na+)���Ըû����Һ�������ж���ȷ����( )
������A.C(H+)��C(OH-) B.C(CH3COOH)��C(CH3COO-)��0.2 mol/L
������C.C(CH3COOH)��C(CH3COO-) D.C(CH3COO-)��C(OH-)��0.2 mol/L
 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| c(H+) | c(OH-) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
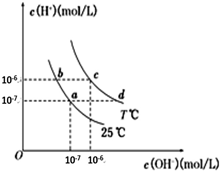
| A��a���Ӧ����Һ��c���Ӧ����ҺpHֵ��С��pH��c����pH��a�� | B��d���Ӧ����Һ�д������ڣ�K+��Ba2+��NO3-��I- | C��25��ʱ��Ka��HF��=3.6��10-4��Ka��CH3COOH��=1.75��10-5��0.1mol/L��NaF��Һ��0.1mol/L ��CH3COOK��Һ��ȣ�c��Na+��-c��F-����c��K+��-c��CH3COO-�� | D����b���Ӧ����Һ��ֻ��NaHA������Һ������Ũ�ȴ�С��c��HA-����c��H2A����c��H+����c��A2-�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
��0.01 mol��L-1��H2A��Һ
��0.01 mol��L-1��NaHA��Һ
��0.02 mol��L-1��HCl��Һ��0.04 mol��L-1��NaHA��Һ��������
��0.02 mol��L-1��NaOH��Һ��0.02 mol��L-1��NaHA��Һ��������
A.������Һ��c(HA-)Ũ�ȴ�С���ۣ��٣��ڣ���
B.��Һ��������Ũ�ȴ�С˳���ǣ�c(H2A)��c(H+)��c(HA-)��c(A2-)��c(OH-)
C.��Һ�����й�����Ũ�ȹ�ϵ��c(HA-)+2c(A2-)+c(H2A)��c(Na+)
D.��Һ�����й�����Ũ�ȹ�ϵ��c(HA-)+c(A2-)+c(OH-)=c(Na+)+c(H+)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ��㶫ʡɽһ����У�����ڶ����������ۻ�ѧ�Ծ��������棩 ���ͣ�ѡ����
���ڳ�����pH=3��������Һ������˵����ȷ����
A����������pH=3������Ƚϣ�������п����Ӧ������H2����
B����ˮϡ�͵�ԭ�����10������ҺpH��Ϊ4
C���������������ƹ��壬��ҺpH����
D����Һ������Ũ�ȴ�С��ϵΪ�� c(H+)>c(CH3COOH) > c(CH3COO-)>c(OH-)
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com