
| A. | 植物油久置会出现油脂的酸败现象,是因为油脂发生了水解 | |
| B. | 有机玻璃、合成橡胶、涤纶都是由加聚反应制得的 | |
| C. | 糖类、油脂、蛋白质的水解产物都是非电解质 | |
| D. | 将已成熟的水果放入未成熟的水果中并密封,可加速水果成熟 |
分析 A.油脂中的碳碳双键受到空气中的氧、水或微生物作用氧化成过氧化物;
B.涤纶是由精对苯二甲酸(PTA)或对苯二甲酸二甲酯(DMT)和乙二醇(EG)为原料经酯化或酯交换和缩聚反应而得到;
C.油脂和蛋白质的水解产物含有羧酸,属于电解质;
D.乙烯具有催熟效果.
解答 解:A.植物油久置会出现油脂的酸败现象,是因为油脂发生了氧化反应,故A错误;
B.涤纶是缩聚反应得到,故B错误;
C.油脂水解产物是高级脂肪酸和甘油,高级脂肪酸属于电解质,蛋白质的水解产物为氨基酸,含有羧基和氨基,属于电解质,故C错误;
D.已成熟的水果产生乙烯,能催熟混放在一起的未成熟的果实,故D正确;
故选:D.
点评 本题主要考查了常见物质的性质与生活常识,难度一般,明确物质的性质是解本题关键,题目难度不大.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
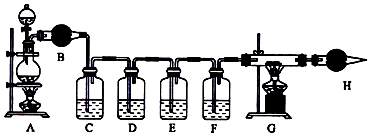
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若混合后溶液中c(H+)>c(OH-),则一定有V1<V2 | |
| B. | 若V1=V2,则二者混合后的溶液中pH>7 | |
| C. | 混合溶液中可能存在:c ( F-)>c (H+)>c (Na+)>c( OH-) | |
| D. | 二者恰好反应完时,则所得溶液中c(F-)=c (Na+) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
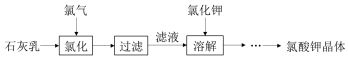
| 加热次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量(g) | c | d | e | e |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
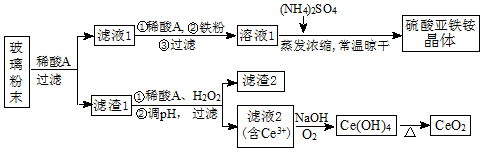
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
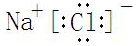 ,反应中被氧化的物质是Fe(OH)3(写化学式).
,反应中被氧化的物质是Fe(OH)3(写化学式).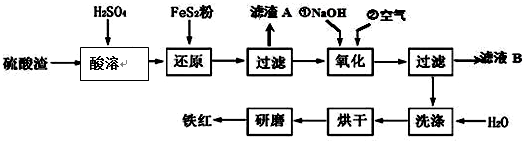
| 沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
| 完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝片与稀盐酸反应 | B. | 灼热的炭与水蒸气的反应 | ||
| C. | Ba(OH)2•8H2O与NH4Cl反应 | D. | 甲烷在氧气中的燃烧反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 电子云中的每个小黑点代表一个电子 | |
| B. | σ键采用“肩并肩”的重叠方式 | |
| C. | 含有配位键的化合物就叫配合物 | |
| D. | 血红素、叶绿素、维生素B12都是配合物 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com