
| A. | 沉淀转化的实质就是沉淀溶解平衡的移动 | |
| B. | 溶解度小的沉淀可以转化成溶解度更小的沉淀 | |
| C. | 25℃时,在饱和AgCl、AgI、Ag2S溶液中所含c(Ag+)不同 | |
| D. | AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度相同 |
分析 A.依据平衡移动原理回答即可;
B.对于相同类型的难溶性盐,一般情况下溶度积大的沉淀较易转化成溶度积小的沉淀;
C.根据溶度积计算Ag+的浓度;
D.依据同离子效应判断即可.
解答 解:A.沉淀转化的实质就是由难溶物质转化为更难溶的物质,故属于沉淀溶解平衡的移动,故A正确;
B.对于相同类型的难溶性盐,一般情况下溶度积大的沉淀较易转化成溶度积小的沉淀,如向AgCl的白色悬浊液中加入KI溶液,可生成AgI沉淀,故B正确;
C.饱和AgCl、AgI、Ag2S溶液中Ag+的浓度分别为:$\sqrt{Ksp(AgCl)}$、$\sqrt{Ksp(AgI)}$、$\root{3}{Ksp(A{g}_{2}S)}$,由于三种物质的Ksp不同,所以Ag+的浓度不同,故C正确;
D.由于溶度积是常数,故氯离子浓度大,则银离子浓度小,所以AgCl固体在等物质的量浓度的NaCl、CaCl2溶液中的溶解程度不相同,故D错误.
故选D.
点评 本题考查难溶电解质的溶解平衡,题目难度中等,注意把握溶度积常数的影响因素及溶度积常数的应用,侧重于考查学生的分析能力和计算能力.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
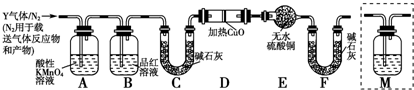
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 4:5 | B. | 2:7 | C. | 2:5 | D. | 2:9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 锅炉水垢用Na2CO3溶液浸泡一段时间后,可用盐酸溶解 | |
| B. | 向Mg(OH)2悬浊液中滴加FeCl3溶液,固体颜色变深 | |
| C. | NaH2PO4溶液显酸性,Na2HPO4溶液显碱性,两种溶液中都有电离平衡和水解平衡 | |
| D. | 等物质的量浓度的(NH4)2CO3,(NH4)2SO4,(NH4)2Fe(SO4)2三种溶液,NH${\;}_{4}^{+}$浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 ;
;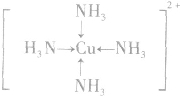 ;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;
;名称是四氨合铜离子;[Cu(NH3)4]2+中的两个NH3被两个Cl-取代,能得到两种不同结构的产物,则[Cu(NH3)4]2+的空间构型为平面正方形;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
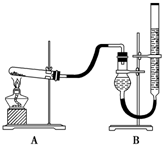 氧化铜是一种黑色粉末,可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂.为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源再生,并减少污染.
氧化铜是一种黑色粉末,可作玻璃和瓷器着色剂、油类的脱硫剂、有机合成的催化剂.为获得纯净的氧化铜以探究其性质,某化学兴趣小组利用废旧印刷电路板获得氧化铜,实现资源再生,并减少污染.| 实验序号 | Ⅰ | Ⅱ | Ⅲ |
| KClO3质量 | 1.2g | 1.2g | 1.2g |
| 其他物质质量 | 无其他物质 | CuO 0.5g | MnO2 0.5g |
| 待测数据 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| H2O2的浓度(质量分数) | 温度(℃) | 催化剂 | |
| A | 5 | 10 | 不使用 |
| B | 5 | 15 | 使用FeCl3 |
| C | 15 | 20 | 不使用 |
| D | 15 | 30 | 使用MnO2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com