

| A. | 图1中醋酸电离平衡常数:a点的比b点的小 | |
| B. | 图1中醋酸溶液的pH:a点的比b点的小 | |
| C. | 图2中c点对应的溶液为Fe(OH)3的不饱和溶液 | |
| D. | 由图2可知,欲除去CuSO4溶液中的Fe3+,可向溶液中加入CuO,调节pH约为4左右 |
分析 A.弱电解质的电离平衡常数只有温度有关,与物质的电离程度无关;
B.弱电解质溶液的导电能力与其离子浓度成正比;
C.如果浓度积常数小于溶液中c3(OH-).c(Fe3+),则为饱和溶液;
D.根据图知,当溶液的pH=4左右时,溶液呈氢氧化铁完全沉淀,而溶液中铜离子不产生沉淀,注意加入的除杂剂不能引进新的杂质离子.
解答 解:A.温度不变,醋酸的电离平衡常数不变,与溶液的浓度无关,所以a和b两点的电离平衡常数相等,故A错误;
B.弱电解质溶液的导电能力与其离子浓度成正比,离子浓度越大其导电性越强,b点溶液导电能力大于a,所以b点的氢离子浓度大于a,则a的pH大于b,故B错误;
C.根据图象知,溶液中中c3(OH-).c(Fe3+)大于氢氧化铁的溶度积常数,溶液c点为过饱和溶液,故C错误;
D.根据图知,当溶液的pH=4左右时,溶液呈氢氧化铁完全沉淀,而溶液中铜离子不产生沉淀,且溶液呈酸性,所以可以加入氧化铜条件溶液的pH且可以出去铁离子,故D正确;
故选D.
点评 本题考查了弱电解质的电离、难溶物的溶解平衡,根据弱电解质电离、难溶物的溶解平衡特点来分析解答即可,注意电离平衡常数、溶度积常数只与温度有关,与溶液的酸碱性、浓度都无关,为易错点.


 优加精卷系列答案
优加精卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1 mol Cl2参加反应转移电子数一定为2NA | |
| B. | 在反应KIO3+6HI═KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA | |
| C. | 根据反应中HNO3(稀)$\stackrel{被还原}{→}$NO,而HNO3(浓)$\stackrel{被还原}{→}$NO2可知,氧化性HNO3(稀)>HNO3(浓) | |
| D. | 含有大量NO3-的溶液中,不能同时大量存在H+、Fe2+、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径比钙小 | |
| B. | 最高价氧化物为SeO3 | |
| C. | H2Se一定是强酸 | |
| D. | 气态氢化物为H2Se,稳定性比H2S 弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热剂焊接钢轨主要利用的是光能 | |
| B. | 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程 | |
| C. | 1g氢气燃烧生成液态水,放出的热量为142.9 kJ,故氢气燃烧热的热化学方程式可以表示为:H2(g)+$\frac{1}{2}$O2(g)═H2O(g)△H=-285.8 kJ/mol | |
| D. | 在温度、压强一定的条件下,自发反应总是向△H-T△S<0的方向进行 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

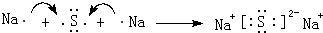 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在晶体硅中,Si原子与Si-Si键数目比为1:2 | |
| B. | 分子晶体中都存在范德华力,分子内都存在共价键 | |
| C. | HF、HCl、HBr、HI四种物质的沸点依次升高 | |
| D. | 干冰和氯化铵分别受热变为气体所克服的粒子间相互作用属于同种类型 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | C3N4晶体是分子晶体 | |
| B. | C3N4晶体中C-N键长比金刚石中C-C要长 | |
| C. | C3N4晶体中每个碳原子连接4个氮原子,每个氮原子连接3个碳原子 | |
| D. | C3N4晶体中微粒间通过离子键结合 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com