


科目:高中化学 来源: 题型:
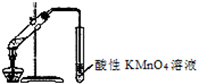 下列实验操作或实验方案设计正确的有.( )
下列实验操作或实验方案设计正确的有.( )| A、②④⑤ | B、①③⑥ |
| C、①③ | D、②④⑥ |
查看答案和解析>>
科目:高中化学 来源: 题型:
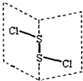 二氯化硫(S2Cl2)广泛用于橡胶工业,分子结构如图.常温下,S2Cl2是一种橙黄色液体,与水迅速反应,并生成能使品红褪色的气体.下列说法正确的是( )
二氯化硫(S2Cl2)广泛用于橡胶工业,分子结构如图.常温下,S2Cl2是一种橙黄色液体,与水迅速反应,并生成能使品红褪色的气体.下列说法正确的是( )A、S2Cl2的电子式: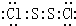 |
| B、S2Cl2为含有极性键和非极性键的非极性分子 |
| C、S2Br2与S2Cl2结构相似,熔沸点:S2Br2<S2Cl2 |
| D、S2Cl2与H2O反应化学方程式可能为:2 S2Cl2+2H2O=SO2↑+3S↓+4HCl |
查看答案和解析>>
科目:高中化学 来源: 题型:
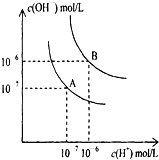 水的电离平衡曲线如图所示.
水的电离平衡曲线如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、利用太阳能制氢 |
| B、关停小火电企业 |
| C、举行“地球一小时”熄灯活动 |
| D、推广使用煤液化技术 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com