
 生成的水及其他产物已略去)
生成的水及其他产物已略去)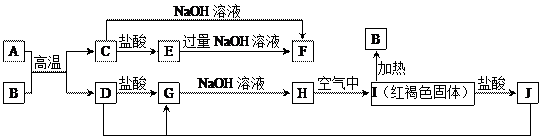
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.碳原子  |
B.P原子价电子轨道表示式 |
| C.Cr原子的价电子排布式 3d44s1 |
| D.Fe2+ 价电子排布式3d44s2 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:问答题
 化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:
化合物A相对分子质量为86,碳的质量分数为55.8%,氢为7.0%,其余为氧。A的相关反应如下图所示:

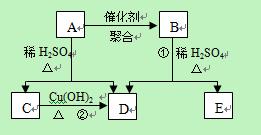

 已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO。
已知R-CH=CHOH(烯醇)不稳定,很快转化为R-CH2CHO。
 根据以上信息回答下列问题:
根据以上信息回答下列问题:
 (1)A的分子式为 ;
(1)A的分子式为 ;
 (2)反应②的化学方程式是 ;
(2)反应②的化学方程式是 ;
 (3)A的结构简式是
(3)A的结构简式是 
 ;(4)反应①的化学方程式是 ;
;(4)反应①的化学方程式是 ;
 (5)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为 。
(5)A的另一种同分异构体,其分子中所有碳原子在一条直线上,它的结构简式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
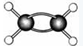 为某有机物的球棍模型(其中
为某有机物的球棍模型(其中 代表氢原子代表
代表氢原子代表 碳原子),该有机物中碳元素与氢元素的质量比m(C):m(H)= 。(相对原子质量C-12、H-l)
碳原子),该有机物中碳元素与氢元素的质量比m(C):m(H)= 。(相对原子质量C-12、H-l) 查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 6。丁为空气的主要成分之一。则丁的电子式为 ,乙的空间构型为 。戊的稀溶液能跟过量铁粉反应,其离子反应方程式为 。
6。丁为空气的主要成分之一。则丁的电子式为 ,乙的空间构型为 。戊的稀溶液能跟过量铁粉反应,其离子反应方程式为 。查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

 关系如下图所示:则原F溶液的浓度为 mol/L。
关系如下图所示:则原F溶液的浓度为 mol/L。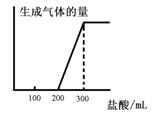
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com