
【题目】有机化合物G是合成维生素类药物的中间体,结构简式为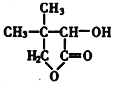 ,由(CH3)2C=CH2为原料合成G的路线如下:
,由(CH3)2C=CH2为原料合成G的路线如下:
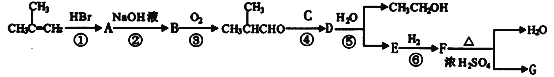
其中A~F分别代表一种有机化合物,合成路线中的部分产物及反应条件已略去。
已知:(i). 
(ii).物质D的分子式为C8H14O4,能发生银镜反应
(iii).第⑤步反应条件为:H2O/H+,E的结构简式为: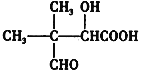
请回答下列问题:
(1)G物质中含有的官能团的名称为________,物质A的名称为________。(用系统命名法命名)
(2)第②步反应的反应类型为____________,物质D的结构简式为________。
(3)写出第③步反应的化学方程式____________________。
(4)同时满足下列条件的E的同分异构体共有____________种,其中核磁共振氢谱只有3组峰,且面积之比为3:1:1的结构简式为____________。
①只含有一种官能团;②链状结构且无-O-O-;③能与NaHCO3反应放出气体
(5)已知: 是一种重要的药物中间体,结合上述信息,请以
是一种重要的药物中间体,结合上述信息,请以![]() 和HCHO为原料设计它的合成路线(无机试剂任选),写出其合成路线__________。
和HCHO为原料设计它的合成路线(无机试剂任选),写出其合成路线__________。
【答案】酯基、羟基 2-甲基-1-溴丙烷 取代反应(或水解反应)  2(CH3)2CHCH2OH+O2
2(CH3)2CHCH2OH+O2![]() 2(CH3)2CHCHO+2H2O 9 HOOC-CH(CH3)-CH(CH3)-COOH
2(CH3)2CHCHO+2H2O 9 HOOC-CH(CH3)-CH(CH3)-COOH 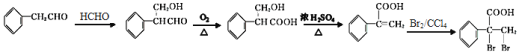
【解析】
异丁烯和HBr发生加成反应生成溴代烃A,A和NaOH的水溶液发生取代反应生成醇B,B被氧气氧化生成异丁醛,则B是(CH3)2CHCH2OH,A是(CH3)2CHCH2Br,异丁醛和C反应生成D,D水解生成乙醇和E,根据E结构简式知,F为OHCH2C(CH3)2CHOHCOOH,F发生消去反应生成水和G,G为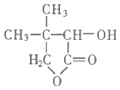 ;D为
;D为 ;
;
(5)由![]() 和HCHO为原料制
和HCHO为原料制 可通过
可通过![]() 和HCHO先发生加成反应生成
和HCHO先发生加成反应生成 ,再利用催化氧化使-CHO氧化为羧基,得到
,再利用催化氧化使-CHO氧化为羧基,得到 ,再和浓硫酸混合加热发生醇的消去反应生成
,再和浓硫酸混合加热发生醇的消去反应生成 ,最后再和Br2/CCl4溶液发生加成反应即可。
,最后再和Br2/CCl4溶液发生加成反应即可。
(1)G为 ,G物质中含有的官能团名称为酯基、羟基,A为(CH3)2CHCH2Br,名称为2-甲基-1-溴丙烷;
,G物质中含有的官能团名称为酯基、羟基,A为(CH3)2CHCH2Br,名称为2-甲基-1-溴丙烷;
(2)第②步反应的反应类型为水解反应或取代反应,物质D的结构简式为 ;
;
(3)B是(CH3)2CHCH2OH,B发生催化氧化反应生成C,则第③步反应的化学方程式 2(CH3)2CHCH2OH+O2![]() 2(CH3)2CHCHO+2H2O;
2(CH3)2CHCHO+2H2O;
(4)E的结构简式为 ,E的同分异构体符合下列条件:①只含有一种官能团;②链状结构且无-O-O-;③能与NaHCO3反应放出气体,说明含有羧基,根据O原子个数及不饱和度知,含有2个-COOH;则:如果主链结构为HOOC-C-C-C-C-COOH,有1种结构;如果主链碳链结构为HOOC-C-C-C-COOH,有2种结构;如果主链碳链结构为HOOC-C-C-COOH,有3种结构;如果主链碳链结构为HOOC-C-COOH,有3种结构,所以符合条件的有9种,其中核磁共振氢谱只有3组峰,且面积之比为3:1:1的结构简式为HOOC-CH(CH3)-CH(CH3)-COOH;
,E的同分异构体符合下列条件:①只含有一种官能团;②链状结构且无-O-O-;③能与NaHCO3反应放出气体,说明含有羧基,根据O原子个数及不饱和度知,含有2个-COOH;则:如果主链结构为HOOC-C-C-C-C-COOH,有1种结构;如果主链碳链结构为HOOC-C-C-C-COOH,有2种结构;如果主链碳链结构为HOOC-C-C-COOH,有3种结构;如果主链碳链结构为HOOC-C-COOH,有3种结构,所以符合条件的有9种,其中核磁共振氢谱只有3组峰,且面积之比为3:1:1的结构简式为HOOC-CH(CH3)-CH(CH3)-COOH;
(5)由![]() 和HCHO为原料制
和HCHO为原料制 可通过
可通过![]() 和HCHO先发生加成反应生成
和HCHO先发生加成反应生成 ,再利用催化氧化使-CHO氧化为羧基,得到
,再利用催化氧化使-CHO氧化为羧基,得到 ,再和浓硫酸混合加热发生醇的消去反应生成
,再和浓硫酸混合加热发生醇的消去反应生成 ,最后再和Br2/CCl4溶液发生加成反应即可,具体合成路线为
,最后再和Br2/CCl4溶液发生加成反应即可,具体合成路线为 。
。


 海淀课时新作业金榜卷系列答案
海淀课时新作业金榜卷系列答案 期末金牌卷系列答案
期末金牌卷系列答案 轻松课堂标准练系列答案
轻松课堂标准练系列答案科目:高中化学 来源: 题型:
【题目】在一定条件下,将3mol A和1mol B两种气体混合于固定容积为2L的密闭容器中,发生如下反应:3A(g) + B(g) ![]() xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
xC(g) + 2D(g)。2min末该反应达到平衡,生成0.8mol D,并测得C的浓度为0.2mol·L-1。下列判断错误的是
A. x=1
B. B的转化率为50%
C. 2min内A的反应速率为0.3mol·L-1·min-1
D. 若混合气体的平均相对分子质量不变,则表明该反应达到平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】全钒液流储能电池是利用不同价态的含钒离子在酸性条件下发生反应,离子方程式为VO2+(黄色)+V2+(紫色)+2H+![]() VO2+(蓝色)+V3+(绿色)+H2O.采用惰性电极实现化学能和电能相互转化的工作原理如图。下列说法正确的是( )
VO2+(蓝色)+V3+(绿色)+H2O.采用惰性电极实现化学能和电能相互转化的工作原理如图。下列说法正确的是( )

A.充电过程中,X端接外接电源的负极
B.放电过程中,正极电极反应式为VO2++H2O+e-=VO2++2OH-
C.放电过程中,右罐溶液颜色逐渐由绿色变为紫色
D.充电时若转移电子0.5mol,左罐溶液中n(H+)的变化量为0.5mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法不正确的是( )
A. 人们最早先根据味道来获得朴素的酸、碱概念:一切有酸味的物质都是酸,一切有涩味的物质都是碱。
B. 波义耳基于指示剂变色来分辨酸碱:酸一定能使石蕊变红,碱一定能使石蕊变蓝。
C. 地球上最大规模的化学反应是植物的光合作用,人类利用氮肥的最有效的反应是合成氨反应。
D. 酸碱质子理论:凡是能给出![]() 的物质就是酸,凡是能结合
的物质就是酸,凡是能结合![]() 的物质就是碱,适用水溶液,也适用非水溶液或无水条件。
的物质就是碱,适用水溶液,也适用非水溶液或无水条件。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种兴奋剂的结构简式如图所示,有关该物质的说法不正确的是 ( )
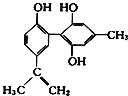
A.该分子中的所有碳原子可能共平面
B.该物质在一定条件下能发生加聚反应
C.滴入酸性KMnO4溶液,观察紫色褪去,能证明结构中存在碳碳双键
D.1 mol该物质与足量浓溴水反应时最多消耗Br2为4 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,用0.100mol/L NaOH 溶液分别滴定20.00mL 0.100mol/L的盐酸和醋酸,滴定曲线如图所示.下列说法正确的是

A. Ⅰ、Ⅱ分别表示盐酸和醋酸的滴定曲线
B. V(NaOH)=10.00 mL 时 >1
>1
C. pH=7时,两种酸所用NaOH溶液的体积相等
D. V(NaOH)=20.00 mL 时,c(Cl-)<c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种利用电解锰阳极泥(主要成分MnO2、MnO)制备MnO2的工艺流程如下:

(1)“煅烧氧化”时,1mol MnO煅烧完全转化为Na2MnO4失去电子的物质的量为___________;MnO2煅烧反应的化学方程式为__________________。
(2)“浸取”时,为提高Na2MnO4的浸取率,可采取的措施有____________、____________(列举2点)
(3)“调pH”是将溶液pH 调至约为10,防止pH较低时Na2MnO4自身发生氧化还原反应,生成MnO2和___________;写出用pH试纸测定溶液pH的操作_______________。
(4)“还原”时有无机含氧酸盐生成,发生反应的化学方程式为_____________。
(5)测定产品中MnO2质量分数的步骤如下:
步骤1. 准确称取mg产品,加入c1mol·L-1Na2C2O4溶液V1mL (过量)及适量的稀硫酸,水浴加热煮沸一段时间。(已知:Na2C2O4+2H2SO4+MnO2=MnSO4+2CO2↑+2H2O+Na2SO4)
步骤2. 然后用c2mol·L-1KMnO4标准溶液滴定剩余的Na2C2O4滴定至终点时消耗KMnO4标准溶液V2mL。(已知:5H2C2O4+2KMnO4+3H2SO4=2MnSO4+10CO2↑+K2SO4+8H2O)
步骤2达滴定终点时判断依据是_____________;产品中MnO2的质量分数为ω(MnO2)=____________(列出计算的表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列有关离子共存的说法中正确的是( )
A.某无色溶液中可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
B.在水电离出![]() 浓度为
浓度为![]()
![]() 的澄淸透明溶液中可能大量存在
的澄淸透明溶液中可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
C.小苏打溶液中,可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
D.使甲基橙呈红色的溶液中,可能大量存在![]() 、
、![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在4 L密闭容器中充入6 mol A气体和5 mol B气体,在一定条件下发生反应: 3A(g)+B(g) ![]() 2C(g)+xD(g) ,已知达到平衡时生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
2C(g)+xD(g) ,已知达到平衡时生成了2 mol C,经测定D的浓度为0.5 mol·L-1,下列判断正确的是( )
A.x=3
B.A的转化率为50%
C.平衡时B的浓度为1.5 mol·L-1
D.达到平衡时,在相同温度下容器内混合气体的压强是反应前的95%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com