
| A、9g | B、10g |
| C、8.5g | D、8g |
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaCl AgNO3 CuSO4 BaSO4 |
| B、BaCl2 AgNO3 CuSO4 Na2SO3 |
| C、Ba(NO3)2 Ag2SO4 CuCl2 Na2SO3 |
| D、Ag2SO4 Ba(NO3)2 CuCl2 Na2SO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
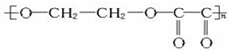 ,下列叙述错误的是( )
,下列叙述错误的是( )| A、A属于醛类 |
| B、A分子中有6个原子,含碳40% |
| C、A的相对分子质量为58 |
| D、1 mol A与足量银氨溶液反应能还原出4 mol 银 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙烯分子与苯分子中的碳碳键不同,但二者都能发生加成反应 |
| B、乙烯、聚氯乙烯分子中都含有不饱和键 |
| C、无水乙醇可用于杀菌、消毒 |
| D、淀粉、油脂、蛋白质都属于高分子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NH3溶于水可导电,所以NH3是电解质 |
| B、Na2O熔融时能导电,所以Na2O是电解质 |
| C、液态的铜导电性很好,所以铜是电解质 |
| D、SO2水溶液的导电性很好,所以SO2是电解质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com